
本发明涉及生物技术领域,厂房保洁13825404095尤其涉及一种大肠杆菌外膜囊泡的制备、载药方法与其在抗肿瘤中的应用。
背景技术:
细菌外膜囊泡(omv)是一种纳米尺寸、双分子层的球状蛋白脂质体。其粒径大约在50-100nm之间。外膜囊泡外表面由磷脂双分子层包绕,富含水溶性蛋白、mrna和microrna等物质。它主要由革兰氏阴性菌分泌并外排出细菌外,是细菌新陈代谢过程的重要途径,同时也是细菌之间进行信号传导的重要媒介。革兰氏阴性菌在其生长期间自发释放外膜囊泡,然而,自发生成的细菌外膜囊泡产量相对较低,往往需要培养大量的细菌才能提取一定质量的外膜囊泡。使用一系列的去污剂处理或超声处理方法,能够通过破坏完整的细菌进而促进细菌产生omv,但此类方法工艺较复杂,往往还需要多步骤提纯,除去化学试剂,或需要外加超声处理。
在应用于药物载体方面,传统的药物载体粒径和毒性较大,合成相对复杂,容易被巨噬细胞等吞噬,载体无法有效到达肿瘤部位。传统药物载体包括阳离子脂质体和阳离子聚合物两大类,它们表面由于永久正电荷的存在,故可以通过静电相互作用与药物结合,但是阳离子脂质体经过静脉注射后,会与带负电荷的血清蛋白结合,导致靶向性差并且无法在体内长时间循环,而外膜囊泡作为一种膜结构的药物载体,凭借其表面带负电荷、粒径小以及生物相容性好等特点,可以通过携载抗肿瘤药物,在体内长时间循环,随后被动靶向到达肿瘤部位,将药物递送至肿瘤细胞内。
目前将药物递送至omv载体内的方法有37℃孵育法、超声法和电穿孔法三种。37℃孵育法依靠自身的细胞膜间隙和浓度梯度使药物由omv外部向omv内部扩散,但omv细胞间隙很小且为脂溶性膜,所以扩散效率很低,导致其载药量低。超声法和电穿孔法可以在一定程度上提高omv的载药量,但需要借助超声仪和电穿孔仪,操作不方便,这些限制均阻碍了omv在药物载体方面的应用。
技术实现要素:
针对以上不足,本发明提供一种大肠杆菌外膜囊泡的制备、载药方法与其在抗肿瘤中的应用,直接使用了一种细菌外膜囊泡诱导剂,使其能够刺激大肠杆菌分泌更多omv,大幅提升了大肠杆菌omv的产量。本发明直接使用一种皂苷类小分子物质,十二烷基麦芽糖苷,当它与omv孵育之后,可以在omv表面形成孔状通道,使小分子药物通过孔状通道渗透进入omv内部,随后采取氯化钙分子封住孔道,将其完全包裹在omv中。方法简便可行,提高omv载药效率,并且后续实验证明携载药物的omv能够明显抑制肿瘤生长,在药物载体领域具有广阔的应用前景。
本发明解决技术问题所采用的技术方案如下:一种大肠杆菌外膜囊泡的制备方法,所述制备方法具体如下:
(1)收集体外培养的大肠杆菌溶液;
(2)将大肠杆菌溶液在0-25℃下离心弃去沉淀,用滤膜过滤上清液,获得无细菌上清液;
(3)用超滤管浓缩步骤(2)得到的无细菌上清液,浓缩后的体积为浓缩前的1/50-1/4;
(4)将浓缩后的无细菌上清液在0-25℃下超速离心,弃去上清,沉淀以pbs缓冲液重悬,重复超速离心、弃去上清液、沉淀重悬于pbs缓冲液,最后即得细菌外膜囊泡。
进一步的,所述步骤(1)中大肠杆菌溶液的获取方法如下:
(1.1)将bl21菌株的冻存液融化,使用接种环挑取细菌溶液,接种于含50μg/ml卡那霉素的固体培养基,37℃培养箱内培养1-48h,再挑取固体培养基上的1个单菌落至含50μg/ml卡那霉素的lb液体培养基,再在37℃下震荡培养1-24h;
(1.2)随后将震荡培养1-24h获得的细菌溶液以体积比为1:100的比例接种至含50μg/ml卡那霉素的lb液体培养基中,继续在37℃下震荡培养,在600nm的波长下,细菌od值达到0.1-0.5时,在lb液体培养基中加入异丙基硫代半乳糖苷(iptg),使异丙基硫代半乳糖苷在lb液体培养基中的最终浓度为1-500μg/ml,继续在37℃下震荡培养1-48h,最终获得大肠杆菌溶液。
进一步的,所述步骤(2)中的离心转速为1000g-10000g,离心时间为1-30min。
进一步的,所述滤膜的孔径为0.2-1μm。
进一步的,所述步骤(4)中的超速离心转速为100000g-200000g,离心时间为0.5-5h。
本发明的另一目的是提供一种大肠杆菌外膜囊泡的载药方法,该方法利用十二烷基麦芽糖苷作为制孔剂将抗肿瘤药物载入大肠杆菌外膜囊泡中,得到携载抗肿瘤药物的细菌外膜囊泡。
进一步的,该方法具体过程如下:
(a)将大肠杆菌外膜囊泡分散在pbs缓冲液中,再向其中加入十二烷基麦芽糖苷,大肠杆菌外膜囊泡、十二烷基麦芽糖苷和pbs缓冲液的质量比为0.1-10:0.1-10:1000,在37℃下震摇0.1-10h;
(b)向步骤(a)制得的溶液中加入抗肿瘤药物,使抗肿瘤药物的最终浓度为1-10mg/ml,在37℃条件下孵育0.1-10h;
(c)向步骤(b)得到的溶液中加入氯化钙,使氯化钙浓度为0.1-1mg/ml,继续在37℃条件下孵育0.1-10h,超速离心,弃去上清液,沉淀重悬于pbs缓冲液,重复超速离心、弃去上清液、沉淀重悬于pbs缓冲液,即得到携载抗肿瘤药物的细菌外膜囊泡。
进一步的,所述抗肿瘤药物为盐酸阿霉素、dna、紫杉醇、顺铂、mrna、吉非替尼、吉西他滨、sirna、氮芥、喷司他丁、阿那曲唑和利妥昔单抗中的一种或几种按任意比混合。
进一步的,所述步骤(c)中的超速离心转速为100000g-200000g,离心时间为0.5-5h。
本发明还提供一种上述大肠杆菌外膜囊泡的载药方法获得的携载抗肿瘤药物的细菌外膜囊泡在抗肿瘤中的应用。
与现有技术相比,本发明具有以下有益效果:
1)本发明首次利用一种简便可行的方式提高了大肠杆菌omv的产率,操作简单、成本较低、可行性高。
2)本发明根据omv自身较高的生物相容性等特点,使其能够携载抗肿瘤药物,与其它传统药物载体相比,理论上能够减少毒性,增加药物载体内循环时间,更好的通过被动靶向的方式达到肿瘤部位。
3)omv不仅能够携载小分子抗肿瘤药物,还能够携载基因类药物,例如sirna等,在抑制肿瘤细胞生长的同时,也可以降低肿瘤细胞的侵袭能力,是一种多功能的药物载体。
4)与omv现有的载药方法相比,本发明首次使用十二烷基麦芽糖苷作为促进载药的试剂,并筛选出合理的孵育浓度,与其它方法相比,本发明操作简单,不破坏omv的膜结构,是一种高效的载药方法。
附图说明
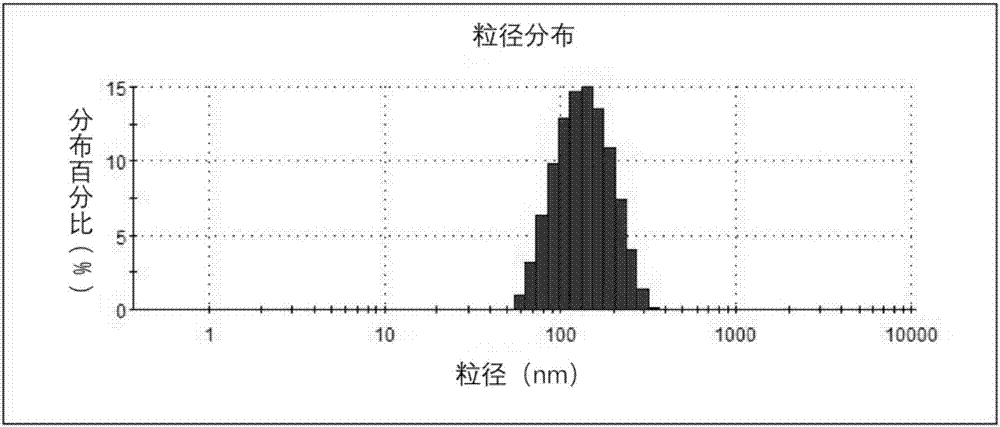
图1为外膜囊泡的粒径图;
图2为外膜囊泡的扫描电镜图;
图3为放大后外膜囊泡的扫描电镜图;
图4为不同方式制得外膜囊泡的产量图;
图5为外膜囊泡三种不同载药方式的载药效果图;
图6为肿瘤细胞对外膜囊泡的摄取效果图;
图7为载药外膜囊泡对肿瘤细胞对的抑制效果图;
图8为载药外膜囊泡对肿瘤细胞对的侵袭能力的抑制效果图。
具体实施方式
下面结合实施例和附图对本发明做进一步的说明。
实施例1:
大肠杆菌外膜囊泡的制备
(1)大肠杆菌的复苏与体外培养
将bl21菌株的冻存液融化,使用接种环挑取细菌溶液,接种于含50μg/ml卡那霉素的固体培养基,37℃培养箱内培养1h,接种固体培养基上1个单菌落至含50μg/ml卡那霉素的lb液体培养基,37℃震荡培养1小时。
随后将细菌溶液以体积比为1:100的比例接种至含50μg/ml卡那霉素的lb液体培养基(已经过高温灭菌),继续37℃震荡培养,当细菌od值(600nm)达到0.1时,在lb液体培养基中加入异丙基硫代半乳糖苷(iptg),使异丙基硫代半乳糖苷在lb液体培养基中的最终浓度为1μg/ml,促进大肠杆菌分泌外膜囊泡,继续在37℃下震荡培养1h。
(2)大肠杆菌外膜囊泡的分离与提纯
收集体外培养的大肠杆菌培养物,在0℃下,1000g离心1min,弃去沉淀,用0.2μm滤膜过滤上清夜,获得无细菌上清液。使用超滤管超滤浓缩上清液,得到浓缩后的无细菌上清液,浓缩后的体积为浓缩前的1/50。在0℃下,100000g超速离心0.5h,弃去上清,沉淀以pbs缓冲液重悬,再次以100000g超速离心0.5h,弃去上清液,沉淀重悬于pbs缓冲液,即得到细菌外膜囊泡。
大肠杆菌外膜囊泡的载药
将所制得的大肠杆菌外膜囊泡分散在pbs缓冲液中,向其中加入十二烷基麦芽糖苷,大肠杆菌外膜囊泡、十二烷基麦芽糖苷和pbs缓冲液的质量比为0.1:0.1:1000,在37℃下震摇0.1h。向大肠杆菌外囊泡溶液中加入抗肿瘤药物,使抗肿瘤药物的最终浓度为1mg/ml,37℃条件下孵育0.1h。抗肿瘤药能够从高浓度梯度向低浓度梯度逐渐扩散,进入大肠杆菌外膜囊泡内。
为了防止药物泄露,需要向溶液中加入氯化钙离子,使氯化钙浓度为0.1mg/ml,继续37℃条件下孵育0.1h,超速离心,弃去上清液,沉淀重悬于pbs缓冲液。重复超速离心,弃去上清液,沉淀重悬于pbs缓冲液,即得到携载抗肿瘤药物的细菌外膜囊泡。
实施例2:
大肠杆菌外膜囊泡的制备
(1)大肠杆菌的复苏与体外培养
将bl21菌株的冻存液融化,使用接种环挑取细菌溶液,接种于含50μg/ml卡那霉素的固体培养基,37℃培养箱内培养48h,接种固体培养基上1个单菌落至含50μg/ml卡那霉素的lb液体培养基,37℃震荡培养24小时。
随后将细菌溶液以体积比为1:100的比例接种至含50μg/ml卡那霉素的lb液体培养基(已经过高温灭菌),继续37℃震荡培养,当细菌od值(600nm)达到0.5时,在lb液体培养基中加入异丙基硫代半乳糖苷(iptg),使异丙基硫代半乳糖苷在lb液体培养基中的最终浓度为500μg/ml,促进大肠杆菌分泌外膜囊泡,继续震荡培养48h。
(2)大肠杆菌外膜囊泡的分离与提纯
收集体外培养的大肠杆菌培养物,在25℃下,10000g离心30min,弃去沉淀,1μm滤膜过滤上清夜,获得无细菌上清液。使用超滤管超滤浓缩上清液,得到浓缩后的无细菌上清液,浓缩后的体积为浓缩前的1/4。在25℃下,200000g超速离心5h,弃去上清,沉淀以pbs缓冲液重悬,再次超速离心,弃去上清液,沉淀重悬于pbs缓冲液,即得到制备的细菌外膜囊泡。
大肠杆菌外膜囊泡的载药
将所制得的大肠杆菌外膜囊泡分散在pbs缓冲液中,向其中加入十二烷基麦芽糖苷,大肠杆菌外膜囊泡、十二烷基麦芽糖苷和pbs缓冲液的质量比为10:10:1000,在37℃下震摇10h。向大肠杆菌外囊泡溶液中加入抗肿瘤药物,使抗肿瘤药物的最终浓度为10mg/ml,37℃条件下孵育10h。抗肿瘤药能够从高浓度梯度向低浓度梯度逐渐扩散,进入大肠杆菌外膜囊泡内。
为了防止药物泄露,需要向溶液中加入氯化钙离子,使氯化钙浓度为1mg/ml,继续37℃条件下孵育10h,超速离心,弃去上清液,沉淀重悬于pbs缓冲液。重复200000g超速离心5h,弃去上清液,沉淀重悬于pbs缓冲液,即得到携载抗肿瘤药物的细菌外膜囊泡。
实施例1和实施例2中的用到的抗肿瘤药物为盐酸阿霉素、dna、紫杉醇、顺铂、mrna、吉非替尼、吉西他滨、sirna、氮芥、喷司他丁、阿那曲唑和利妥昔单抗中的一种或几种按任意比混合。
实施例3:
大肠杆菌外膜囊泡的验证
(1)对大肠杆菌外膜囊泡进行粒径测量
首先使用pbs缓冲液将实施例1合成好的外膜囊泡调整至100μg/ml,在马尔文激光粒径仪下测量外膜囊泡的尺寸,结果如图1所示。
(2)对外膜囊泡进行形态观察
取实施例1外膜囊泡溶液,滴加在专用铜网上,直接在扫描电镜下观察外膜囊泡的大小和形态,结果如图2、图3所示。
(3)考察大肠杆菌外膜囊泡产率
取实施例1外膜囊泡溶液,加入溶菌酶(1mg/ml),室温震摇30min。随后使用bca蛋白试剂盒检测蛋白浓度,即得到实施例1所制得外膜囊泡浓度。
取未经异丙基硫代半乳糖苷(iptg)处理的大肠杆菌所制得外膜囊泡溶液,加入溶菌酶(1mg/ml),室温震摇30min。随后使用bca蛋白试剂盒检测蛋白浓度,即得到未经异丙基硫代半乳糖苷(iptg)处理的外膜囊泡浓度。两种不同的培养方法所制备的外膜囊泡的产率如图4所示。
(4)考察不同方法大肠杆菌外膜囊泡的载药效率
取实施例1制得的含有药物的外膜囊泡溶液,加入溶菌酶(1mg/ml),室温震摇30min。随后使用高效液相色谱法检测溶液中药物的浓度,并与总投药量相比较,得出化学药物的载药效率。
取实施例1制得的外膜囊泡溶液,加入药物(1mg/ml),与外膜囊泡溶液孵育10min,随后使用电穿孔仪(eppendorfag,hamburg,germany),以1000kv电击5ms,最终在37℃条件下孵育30min,即得载药的外膜囊泡溶液。取上述外膜溶液,加入溶菌酶(1mg/ml),室温震摇30min。随后使用高效液相色谱法检测溶液中药物的浓度,并与总投药量相比较,得出电穿孔法制备得到的药物载药效率。
取实施例1制得的外膜囊泡溶液,加入药物(1mg/ml),在37℃条件下孵育24h,即得载药的外膜囊泡溶液。取上述外膜溶液,加入溶菌酶(1mg/ml),室温震摇30min。随后使用高效液相色谱法检测溶液中药物的浓度,并与总投药量相比较,得出37℃孵育法制备得到的药物载药效率。
三种不同的载药方法制备外膜囊泡的载药效率如图5所示。
(5)考察载药的外膜囊泡溶液的细胞摄取效果
以每孔2×104个细胞的密度将对数生长的b16f10细胞种在细胞培养板中,置于细胞培养箱培养24小时后,除去培养液并用pbs洗两遍,每孔加入500μl不含血清的dmem高糖培养液。用5wt%蔗糖水溶液稀释载药的外膜囊泡溶液,加入上述药物溶液,使其细胞药物的孵育为10μg/ml。在37℃,5wt%co2条件下与b16f10细胞孵育12小时后,除去培养液,加入200μl4%多聚甲醛固定30min,pbs洗涤2次,每次10min,每个样品加200μldapi(1μg/ml)染色液,室温避光反应10min,pbs洗涤2次,立即在激发波长为550nm的条件下,使用荧光显微镜观察荧光的分布情况。结果如图6所示。
(6)考察载药的外膜囊泡溶液的抗肿瘤效果
以每孔1×104个细胞的密度将对数生长的b16f10细胞种在96孔板中,置于细胞培养箱培养24小时后,除去培养液并用pbs洗两遍,每孔加入100μl不含血清的dmem高糖培养液。用5wt%蔗糖水溶液稀释载药的外膜囊泡溶液,加入上述药物溶液,使其细胞药物的孵育浓度分别为1μg/ml、5μg/ml以及10μg/ml。在37℃,5wt%co2条件下与b16f10细胞孵育24小时后,每孔加入20μl浓度为5mg/mlmtt溶液,孵育4h后除去培养液,每孔加入150μldmso,振摇使结晶完全溶解后,在酶标仪上于570nm下测定各组od值。结果如图7所示。
(7)考察载药的外膜囊泡溶液对细胞侵袭的影响
用transwell培养板(直径6.5mm,孔径8μm)考察b16f10的体外侵袭能力。将b16f10细胞,按照每孔5×104个细胞的密度种在24孔板中,置于细胞培养箱培养24小时后,弃去培养液并用pbs洗两遍,每孔加入500μl不含血清的dmem高糖培养液。用5wt%蔗糖水溶液稀释载药的外膜囊泡溶液,调整其药物浓度至100μg/ml。加入40μl上述溶液,5wt%co2条件下继续培养24小时。随后将细胞以每孔3×104的浓度加入transwell板的上层,下层加入600μl含有10wt%血清的培养液,继续培养48h,取出上层插件,用棉签轻轻擦去膜上层的细胞,侵袭到下层的细胞用4wt%多聚甲醛固定20min,pbs洗三次,细胞用结晶紫染色。使用荧光显微镜观察细胞的侵袭情况,结果如图8所示。