
香蕉枯萎病是由尖孢镰刀菌古巴专化型Fusarium oxysporum f. sp. cubense(Foc)侵染引起的一种土传病害,陪护老人13825404095给世界香蕉产业带来了巨大的经济损失[-]。目前防治香蕉枯萎病的常用措施主要有土壤熏蒸[]、轮作[]和培育新品种[]等。然而土壤熏蒸会破坏土壤环境,与农业可持续发展的理念相悖[]; 病原菌产生的厚垣孢子在无宿主的情况下可长期存活于土壤中[],因此,土壤一旦被Foc侵染,在长达30年的时间易感病香蕉品种均难以成功种植[]; 抗病新品种的培育周期长,且品质难以保证[]。因此,香蕉枯萎病的防治亟需新方法。
生物防治作为一种有前途且环境友好的病害防治方式,正受到广泛的关注,为香蕉枯萎病的防治提供了一种新的、有潜力的方式[]。在众多的生防微生物中,生防真菌相比于生防细菌而言有更大的潜力在土壤中生长和繁殖[],因此,真菌更多地用于防治某些作物因尖孢镰刀菌引起的病害[],目前已有许多生防真菌用于枯萎病的防治[-]。尽管许多不同的生防真菌对枯萎病的防治表现出了一定的防效,但是由于在生物防治过程中,生物和非生物因素相互作用的复杂性,对枯萎病防治的实际效果不尽相同[],为此可通过多种生防菌的结合应用解决该问题。多种拮抗菌结合施用较一种拮抗菌单独施用有更好的防病效果[],大量研究[-]表明多种生防菌结合施用能有效地抑制枯萎病。本研究的前期工作证明香蕉施用多种生防真菌制成的复合菌剂,对香蕉枯萎病有明显的防治效果。已有研究[-]报道了某些种类的生防真菌防病机理是直接对抗和间接对抗,但是多种生防真菌配合的防病机理尚不明确。本文假设复合真菌制剂防治香蕉枯萎病的机理可能在于,香蕉定植前在香蕉根区接种复合真菌制剂改变了香蕉根区土壤微生物结构,刺激了土著微生物中某些有益菌属相对丰度的增加。为研究复合真菌制剂防控香蕉枯萎病的效果,本研究开展了两次盆栽试验,通过细菌16S rRNA基因和真菌ITS区域的高通量测序,系统研究了根区细菌和真菌群落结构对复合真菌制剂的响应,以期探讨复合真菌制剂防治香蕉枯萎病的机理,为以复合真菌制剂防治大田香蕉枯萎病的应用提供理论依据。
1 材料与方法 1.1 供试材料盆栽试验于华南农业大学温室进行。供试土壤为微碱性砂壤土,是滩涂填海造田的蕉园土壤,采自广东省中山市翠亨岛,土壤pH 7.41,有机质含量19.78 g∙kg-1,矿质态氮11.12 mg∙kg-1,有效磷8.53 mg∙kg-1,速效钾141.0 mg∙kg-1。
供试香蕉为巴西蕉(Mimosa nana Lour.)无病组培苗的假植苗。香蕉假植苗长至14 cm、7片绿叶时,选取生长健壮、一致的幼苗进行试验。
复合真菌活菌制剂由西北农林科技大学植保学院植物病理研究室提供,复合真菌制剂NFP由非致病性尖孢镰刀菌(non-pathogenic Fusarium oxysporum sp.)和淡紫拟青霉菌(Paecilomyces sp.)按1:1比例复配而成,复合真菌制剂NFPT由非致病性尖孢镰刀菌(non-pathogenic Fusarium oxysporum sp.)、淡紫拟青霉菌(Paecilomyces sp.)和木霉菌(Trichoderma sp.)按9:9:4的比例复配而成。有效活菌数均大于5×108 g-1。
1.2 试验设计分别于2017年9月27日至2018年1月29日和2018年5月10日至2018年8月1日开展了两次盆栽试验。两次试验结果的规律一致,本文以第二次盆栽试验的结果进行分析和讨论。两次盆栽试验方案相同,分别设置CK(不接种生防菌剂)、复合菌剂NFP、复合菌剂NFPT 3个处理,每个处理设30个重复,单株为1个重复,每盆移栽一株香蕉,共90盆香蕉,随机排列。所有处理的香蕉氮磷钾用量相等,N:P2O5:K2O(质量比)均为1:0.25:0.75。每个处理的施N量均为0.2 g∙kg-1干土,在香蕉生长过程将各处理的总养分均分为12份,分别溶于水后,每周浇灌施肥1次。每盆的含水量用称重法保持在田间持水量的70%。
1.3 试验方法在香蕉苗假植期对其进行复合菌剂接种,具体方法是将三叶期的香蕉苗从沙培苗床中拔出,洗掉根上附着的河沙,假植于7 cm×10 cm的黑色营养杯中,定植介质是无病椰糠+泥炭专用混合基质,假植苗移栽时,将2 g复合菌剂NFP和NFPT分别施于定植穴,使菌剂与香蕉根直接接触。假植期进行正常水肥管理,待香蕉苗长至7片叶时,选择生长一致的香蕉苗移栽于盆钵,开始香蕉盆栽试验。盆栽期按照上述方法进行水肥管理,参考大田管理措施进行香蕉枯萎病外的其他病虫害防治。
香蕉尖孢镰刀菌古巴专化型4号生理小种(Foc4)由华南农业大学农学院植物病理研究室提供。将Foc4接种于马铃薯葡萄糖琼脂培养基(PDA)上,在25 ℃下黑暗活化培养7 d,然后用直径8 mm打孔器从菌落边缘采取菌饼,接种于装有500 mL液体PDA培养基的锥形瓶中,在28 ℃、180 r∙min-1摇床培养7 d。将得到的菌悬液用四层纱布过滤掉菌丝后,用无菌水稀释至106 CFU∙mL-1备用。
供试土壤分两层装盆,先装下层4 cm (约1.5 kg),顶层7 cm(约2.5 kg)先不装土,移栽假植苗后再用土壤覆盖香蕉苗及其基质块。移栽前将选好的七叶一心健壮、一致的香蕉苗脱掉营养钵袋,移植于已装下层土壤的盆钵正中,然后将预留的顶层土壤覆盖于香蕉苗基质块周围,使基质块上仍能覆盖1 cm土壤。每盆移栽1株香蕉,浇水至田间持水量的70%进行缓苗。移栽的香蕉正常生长1个月后,采用伤根接种法接种病原菌。具体操作方法为用洁净玻棒在香蕉假茎四周每个方位自上而下插入土壤中后拔出,分别在插入的四个方位中接种10 mL浓度为106 CFU∙mL-1的Foc4菌悬液,接种量为104 CFU∙g-1(干土)。
1.4 样品采集与指标测定接种病原菌后每隔10 d调查1次,连续调查5次并计算病情指数[]。香蕉枯萎病病情分为6级[],0级:健株,无症状; 1级:病株有20%以下的叶片显病症; 2级:病株有20%~40%的叶片显病症; 3级:病株有40%~80%的叶片显病症; 4级:仅有顶部1~2片健康叶; 5级:整株枯死。
$ 病情指数 / \%=\sum \frac{ { 各级病株数\times该级级数值 }}{ { 总株数 } \times { 最高级级数值 }} \times 100 \\ 防病效果/\%=[(对照病情指数-处理病情指数)/对照\\ 病情指数] \times 100 $香蕉枯萎病发病初期,每处理随机选取12盆香蕉,用土钻取土,每盆取4钻,每4盆的土壤混合均匀后得到1个混合样,每处理3个混合土样,即3个重复,3个处理共9个土壤样品,用自封袋低温带回实验室,去除植物根系并过2 mm筛后保存于-80℃冰箱,用于16S rRNA和ITS测序分析。
采用土壤DNA提取试剂盒(Omega Bio-tek,Norcross,GA,美国)提取土壤微生物总DNA,用紫外可见分光光度计(NanoDrop 2000,Thermo Scientific,Wilmington,美国)检测提取的DNA的浓度和纯度。用1%琼脂糖凝胶电泳检测DNA的完整性。
样本总DNA提取后,设计基因特异性引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′- GGACTACHVGGGTWTCTAAT-3′)对细菌16S rRNA基因的V3~V4区域进行PCR扩增; 真菌特异性引物ITS1F(CTTGGTCATTTAGAGGAAGT AA)和ITS2R(GCTGCGTTCTTCATCGATGC)用来扩增真菌内部转录区(ITS)的ITS1区域。PCR反应程序为95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,细菌16S rRNA 27个循环,真菌ITS 35个循环; 72 ℃延伸10 min。对扩增产物进行纯化、定量和均一化,形成测序文库,由上海美吉生物医药科技有限公司通过Illumina MiSeq平台进行测序。
土壤样本尖孢镰刀菌(F. oxysporum)的丰度用实时荧光定量PCR(RT-qPCR)法测定,上游引物FOC1(CAGGGGATGTATGAGGAGGCT)和下游引物FOC2(GTGACAGCGTCGTCTAGTTCC)[]用来扩增rRNA内部转录区(ITS)。PCR反应程序为95℃变性10 min,95 ℃退火15 s,60 ℃延伸1 min,40个循环。
1.5 数据统计与分析采用SPSS 20.0和EXCEL 2007软件进行数据处理。采用Origin Pro 8.1软件进行作图。对Illumina Miseq测序得到的原始细菌和真菌序列进行成对读长(Paired-end reads,PE reads)拼接、质控过滤和去除单序列、嵌合体; 使用UPARSE软件对优化后的序列在97%的相似度水平下进行聚类得到分类操作单元(OTU),采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并比对细菌(Silva)和真菌(UNITE)的分类学数据库对OTU进行分类学注释,统计各样本的群落组成。利用MOTHUR(version v.1.30.1)软件进行微生物阿尔法(Alpha)多样性指数的计算,包括Sobs指数、Chao1指数、辛普森指数(Simpson)和覆盖度Good’s coverage指数。利用Qiime软件计算beta多样性距离矩阵,R语言进行主坐标分析(PCoA)分析和作图。利用Qiime软件进行Mantel test分析。利用R(V2.15.3)pheatmap工具包计算皮尔森(Pearson)相关系数。
2 结果 2.1 复合菌剂对香蕉枯萎病防病效果和病原菌数量的影响复合菌剂对香蕉枯萎病病情指数和防病效果的影响如所示。由可知,CK处理病情指数在各个时期均最高。在接种病原菌后15 d,CK处理最先发病,其次是NFP处理。随着香蕉的生长,各处理病情指数均上升。接种35 d后,CK处理病情指数迅速上升,至接种后55 d,CK处理病情指数高达65%,而NFP和NFPT处理病情指数增长缓慢且显著低于CK处理,较CK分别低28%和31%。

将CK的防病效果指定为0时,NFP和NFPT处理的防病效果分别为43%和48%()。
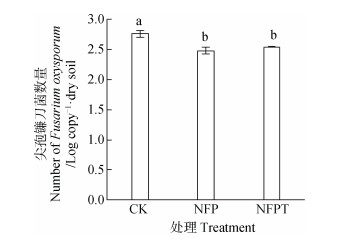
由各处理病原菌qPCR分析结果可知(),复合菌剂处理(NFP和NFPT)病原菌数量显著低于CK处理(P < 0.05),其中复合菌剂NFP处理病原菌数量最低,较CK降低了10.15%。以上结果表明,复合菌剂处理(NFP和NFPT)香蕉枯萎病病情指数和病原菌数量均显著低于CK处理,对香蕉枯萎病的防效显著。
在去除短的、低质量的序列、单序列和嵌合体后,9个样本共获得244 105条高质量16S rRNA序列和556 075条高质量ITS序列用于后续的群落分析。将每个样本的测序量按最小样本序列数(细菌为20 041条序列、真菌为41 942条序列)抽平至相同的测序深度后按照97%的相似性进行聚类,分别得到1 771个细菌分类操作单元(OTUs)和836个真菌分类操作单元(OTUs)。细菌和真菌的平均样本覆盖度(Average Good’s coverage)分别为98.5%和99.8%,并且细菌和真菌的稀释曲线渐趋平缓,这两者共同说明了对样本土壤微生物群落的测序数据达到饱和,能够覆盖样本中的绝大部分物种。
阿尔法多样性分析可用来研究环境中微生物的多样性,通过单样本的阿尔法多样性分析反映微生物群落的丰富度和多样性。Sobs和Chao1指数可用来反映群落的丰富度,指数越大,表明物种总数越大。辛普森指数可用来反映群落的多样性,辛普森值越大,说明群落多样性越低。由可以看出,与CK相比,NFPT处理对土壤细菌丰度无显著性的影响,对真菌丰度提高有促进作用。复合菌剂NFP和NFPT处理后土壤真菌辛普森指数显著低于CK处理,说明施用复合菌剂可显著提高土壤中真菌群落多样性。
表 1 Table 1
![]()
表 1 不同处理土壤微生物群落的丰富度和多样性指数 Table 1 Richness and diversity index of the soil microbial community relative to treatment
处理
Treatment
细菌
Bacteria16S
真菌
Fungus ITS
Sobs指数
Sobs index
Chao1指数
Chao 1 index
辛普森指数
Simpson index
Sobs指数
Sobs index
Chao1指数
Chao 1 index
辛普森指数
Simpson index
CK
1 442±20a
1 647±30a
0.01±0a
370.0±4.0a
446.5±14.2a
0.15±0.00a
NFP
1 439±16a
1 651±5a
0.01±0a
404.3±57.0a
458.7±45.9a
0.08±0.02b
NFPT
1 453±3a
1 644±25a
0.01±0a
393. 7±22.2a
455. 85±20.0a
0.08±0.01b
注:表中数值均为均值±标准误,同列数值后小写字母不同表示处理间差异显著。Note:The values in the table were of mean±deviation. Different letters in the same column mean significant differences at the P < 0.05 probability level according to ANOVA.
主坐标分析(PCoA分析,Principal co-ordinates analysis)是一种非约束性的数据降维分析方法,可用PCoA分析来研究样本群落组成的相似性或差异性。基于Bray-curtis距离算法的主坐标分析结果表明,不同处理间土壤微生物群落结构差异明显()。对细菌和真菌群落结构而言,不同处理间差异明显(置换多元方差分析PERMANOVA:细菌,R2=0.256,P=0.001;真菌,R2=0.318,P=0.006)。前两个主成分约分别解释细菌和真菌群落总变异的47.47%和59.97%。此外,第一主成分(PC1)是最重要的,且CK处理和复合菌剂处理(NFP和NFPT)细菌和真菌群落组成在第一主成分轴上(PC1)有显著差异,Bray-curtis距离矩阵在第一主成分轴上(PC1)对细菌和真菌群落组成差异的解释度分别为29.45%和43.14%。

各处理土壤细菌在门和属分类水平上相对丰度情况如和所示。由可知,各处理土壤细菌丰度前10优势菌门从高至低分别为变形菌门Proteobacteria、放线菌门Actinobacteria、绿弯菌门Chloroflexi、酸杆菌门Acidobacteria、芽单胞菌门Gemmatimonadetes、硝化螺旋菌门Nitrospirae、拟杆菌门Bacteroidetes、厚壁菌门Firmicutes、蓝细菌门Cyanobacteria、Parcubacteria,大约占各处理土壤细菌总序列数的98%以上。由可以看出,与CK处理相比,施用复合菌剂处理(NFP和NFPT)对土壤细菌放线菌门Actinobacteria、酸杆菌门Acidobacteria、浮霉状菌门Planctomycetes丰度的提高有促进作用。CK处理有较高的变形菌门Proteobacteria、芽单胞菌门Gemmatimonadetes、厚壁菌门Firmicutes相对丰度。由可以看出,各处理土壤细菌前5优势属分别为norank_c__Acidobacteria、大理石雕菌属Marmoricola、链霉菌属Streptomyces、类诺卡氏菌属Nocardioides、土微菌属Pedomicrobium。与CK处理相比,施用复合菌剂处理(NFP和NFPT)有利于土壤细菌大理石雕菌属Marmoricola、类诺卡氏菌属Nocardioides和德沃斯氏菌属Devosia相对丰度的提高。CK处理有较高的链霉菌属Streptomyces和土微菌属Pedomicrobium相对丰度。
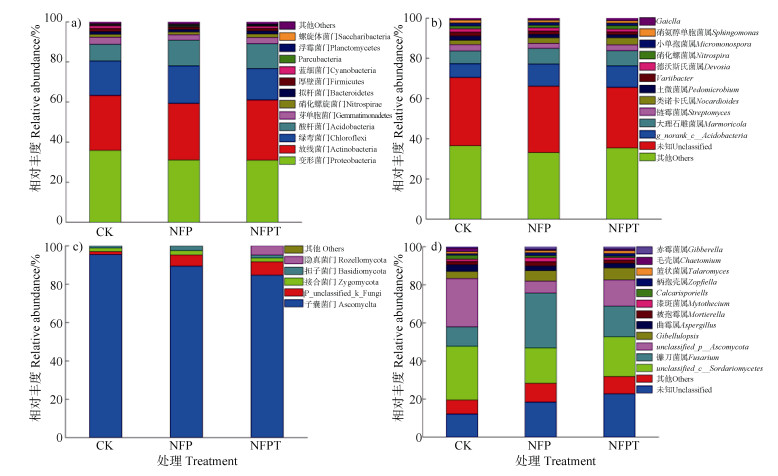
各处理土壤真菌在门和属分类水平上相对丰度情况如和所示。由可以看出,各处理90%以上的土壤真菌序列属于子囊菌门Ascomycota、接合菌门Zygomycota、担子菌门Basidiomycota。与CK处理相比,施用复合菌剂处理(NFP和NFPT)有利于增加土壤真菌接合菌门Zygomycota、unclassified_k__Fungi、担子菌门Basidiomycota相对丰度,CK处理有较高的子囊菌门Ascomycota相对丰度。由可以看出,各处理土壤真菌前5优势属分别为unclassified_ c__Sordariomycetes、镰孢菌属Fusarium、unclassified_p__Ascomycota、Gibellulopsis属、曲霉属Aspergillus。与CK处理相比,施用复合菌剂处理(NFP和NFPT)镰刀菌属Fusarium、Gibellulopsis属相对丰度明显升高,unclassified_c__Sordariomycetes、unclassified_p__Ascomycota、曲霉属Aspergillus、Calcarisporiella属、毛壳菌属Chaetomium相对丰度明显下降。
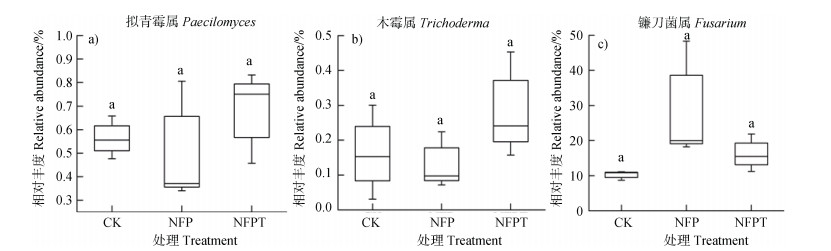
由可知,复合真菌制剂NFP处理拟青霉属Paecilomyces相对丰度在3个处理中最高,但各处理间差异不显著; 复合真菌制剂NFPT处理木霉属Trichoderma相对丰度较CK处理高(),但差异未达显著水平。此外,由可以看出,施用复合菌剂处理(NFP和NFPT)镰刀菌属相对丰度高于CK处理,但差异也未达到显著水平。
由Mantel Test分析可知,土壤细菌和真菌群落组成与香蕉枯萎病病情指数显著相关(细菌,R=0.509,P=0.001;真菌,R=0.370,P =0.035)。由可知,公认的与植物抑病相关的细菌门类相对丰度,如拟杆菌门Bacteroidetes和放线菌门Actinobacteria与香蕉枯萎病病情指数呈负相关,但相关性不显著。包含多种丛枝菌根的球囊菌门Glomeromycota相对丰度与香蕉枯萎病病情指数也无显著相关性。但是变形菌门Proteobacteria、芽单胞菌门Gemmatimonadetes、厚壁菌门Firmicutes和子囊菌门Ascomycota相对丰度与香蕉枯萎病病情指数显著正相关,酸杆菌门Acidobacteria相对丰度与香蕉枯萎病病情指数显著负相关。
表 2 Table 2
![]()
表 2 土壤细菌和真菌门相对丰度与香蕉枯萎病病情指数的皮尔森相关系数 Table 2 Pearson correlation coefficients between the abundances of selected phyla of bacteria and fungi and Fusarium wilt disease severity index
门①
相对丰度②/%
门①
相关系数③
变形菌门Proteobacteria
32.60
变形菌门Proteobacteria
0.854**
放线菌门Actinobacteria
28.62
放线菌门Actinobacteria
-0.379
绿弯菌门Chloroflexi
17.23
绿弯菌门Chloroflexi
0.039
酸杆菌门Acidobacteria
11.20
酸杆菌门Acidobacteria
-0.758*
芽单胞菌门Gemmatimonadetes
3.111
芽单胞菌门Gemmatimonadetes
0.708*
硝化刺菌门Nitrospirae
1.499
硝化刺菌门Nitrospirae
-0.350
拟杆菌门Bacteroidetes
1.383
拟杆菌门Bacteroidetes
-0.131
厚壁菌门Firmicutes
1.305
厚壁菌门Firmicutes
0.703*
蓝细菌门Cyanobacteria
0.961
蓝细菌门Cyanobacteria
0.520
浮霉状菌门Planctomycetes
0.369
浮霉状菌门Planctomycetes
-0.605
子囊菌门Ascomycota
89.85
子囊菌门Ascomycota
0.664*
unclassified_k__Fungi
4.852
unclassified_k__Fungi
-0.633
结合菌门Zygomycota
1.968
结合菌门Zygomycota
-0.154
担子菌门Basidiomycota
1.727
担子菌门Basidiomycota
-0.372
球囊菌门Glomeromycota
0.009
球囊菌门Glomeromycota
-0.192
注:*表示相关性在5%水平差异显著; **表示相关性在1%水平差异显著。下同。Note:* indicates significant correlation at the 5% level; ** significant correlation at the 1% level. The same below. ①Phyla,②Relative abundance,③Correlation coefficient.
由可知,细菌norank_f__ Gemmatimonadaceae、Variibacter、鞘氨醇单胞菌属Sphingomonas、芽孢杆菌属Bacillu相对丰度与香蕉枯萎病病情指数显著正相关。真菌unclassified_c__ Sordariomycetes、曲霉菌属Aspergillus、Calcarisporiella、unclassified_p__Ascomycota、毛壳菌属Chaetomium相对丰度与香蕉枯萎病病情指数显著正相关。尽管公认的有益菌属如类芽孢杆菌属Paenibacillus、木霉属Trichoderma相对丰度与香蕉枯萎病病情指数相关性不显著,一些潜在的生防属如norank_c__Acidobacteria、大理石雕菌属Marmoricola、类诺卡氏菌属Nocardioides、norank_c__Gitt-GS-136、norank_f__Blastocatellaceae __Subgroup_4_、norank_f__Planctomycetaceae、DS-100属、野野村式菌属Nonomuraea、Gibellulopsis属相对丰度与香蕉枯萎病病情指数显著负相关。有趣的是,镰刀菌属Fusarium相对丰度与香蕉枯萎病病情指数呈现负相关,但相关性不显著。由可以看出,复合菌剂处理(NFP和NFPT)镰刀菌属相对丰度高于CK处理,但差异未达到显著水平; 进一步的qPCR结果()显示复合菌剂处理(NFP和NFPT)病原菌尖孢镰刀菌数量显著低于CK处理。
表 3 Table 3
![]()
表 3 土壤细菌和真菌属相对丰度与香蕉枯萎病病情指数的皮尔森相关系数 Table 3 Pearson correlation coefficients between the abundances of selected genera of bacteria and fungi and Fusarium wilt disease severity index
属Genera
相对丰度①/%
属Genera
相关系数②
norank_c__Acidobacteria
9.591
norank_c__Acidobacteria
-0.755*
大理石雕菌属Marmoricola
7.187
大理石雕菌属Marmoricola
-0.628*
类诺卡氏菌属Nocardioides
2.813
类诺卡氏菌属Nocardioides
-0.638*
norank_f__Gemmatimonadaceae
2.393
norank_f__Gemmatimonadaceae
0.784*
Variibacter
1.672
Variibacter
0.843**
鞘氨醇单胞菌属Sphingomonas
1.230
鞘氨醇单胞菌属Sphingomonas
0.749*
芽孢杆菌属Bacillus
0.530
芽孢杆菌属Bacillus
0.737*
norank_c__Gitt-GS-136
0.117
norank_c__Gitt-GS-136
-0.776*
norank_f_Blastocatellaceae_Subgroup_4
0.216
norank_f_Blastocatellaceae_Subgroup_4
-0.808**
norank_f_Planctomycetaceae
0.207
norank_f_Planctomycetaceae
-0.742*
DS-100
0.096
DS-100
-0.705*
野野村式菌属Nonomuraea
0.057
野野村式菌属Nonomuraea
-0.736*
类芽孢杆菌属Paenibacillus
0.120
类芽孢杆菌属Paenibacillus
0.279
链霉菌属Streptomyces
2.830
链霉菌属Streptomyces
0.407
镰刀菌属Fusarium
18.42
镰刀菌属Fusarium
-0.544
支顶孢属Acremonium
0.157
支顶孢属Acremonium
-0.308
链格孢属Alternaria
0.031
链格孢属Alternaria
-0.337
青霉菌属Penicillium
0.619
青霉菌属Penicillium
-0.261
unclassified_c__Sordariomycetes
22.52
unclassified_c__Sordariomycetes
0.749*
unclassified_p__Ascomycota
15.14
unclassified_p__Ascomycota
0.851**
Gibellulopsis
5.183
Gibellulopsis
-0.769*
Calcarisporiella
1.334
Calcarisporiella
0.752*
毛壳菌属Chaetomium
1.138
毛壳菌属Chaetomium
0.75*
曲霉菌属Aspergillus
2.756
曲霉菌属Aspergillus
0.737*
木霉属Trichoderma
0.192
木霉属Trichoderma
-0.287
拟青霉属Paecilomyces
0.583
拟青霉属Paecilomyces
-0.038
①Relative abundance,②Correlation coefficient
香蕉枯萎病是香蕉生产过程中毁灭性的土传病害,已引起世界各香蕉生产国的广泛关注,生物防治是香蕉土传枯萎病防治的理想途径[]。本研究试图探究复合菌剂抑制香蕉枯萎病的可能机制。研究结果表明,复合菌剂处理(NFP和NFPT)香蕉枯萎病病情指数显著低于CK处理(),对香蕉枯萎病有较高的防效,且病原菌qPCR结果显示,复合菌剂NFP和NFPT处理病原菌数量显著低于CK处理(),这与Larkin和Fravel等[]报道的多种拮抗菌混合施用能更好地防治番茄枯萎病的结果一致。
3.2 复合菌剂对根区土壤微生物多样性的影响土壤微生物群落多样性是反映土壤健康的重要指标,土壤微生物群落是土壤生态系统持续发挥作用的重要媒介,优化的土壤微生物结构对防治土传病害有积极的促进作用[]。本研究通过Illumina MiSeq平台进行细菌16S rRNA和真菌ITS测序,分析了土壤细菌和真菌群落多样性。采用绝对定量PCR(qPCR)分析了病原菌的数量。研究结果表明,复合菌剂NFP和NFPT处理对土壤细菌和真菌群落丰富度的增加有促进作用,且显著增加了真菌群落的多样性(),且有研究[-]表明更高的土壤微生物群落丰富度和多样性在提高土壤抗病性的过程中有重要的作用。本试验中施用复合菌剂NFP和NFPT后,土壤微生物群落发生了显著的变化,基于Bray-curtis距离矩阵的PCoA分析结果表明,复合菌剂NFP和NFPT拥有结构上与CK处理明显不同的细菌和真菌群落(),且Mantel Test分析结果表明土壤细菌和真菌群落组成与香蕉枯萎病病情指数显著相关(细菌,R=0.509,P =0.001;真菌,R=0.370,P =0.035;和),说明土壤微生物群落结构差异可能是调控香蕉枯萎病发生的主要因子之一[]。综上所述,在土壤中施入两种复合菌剂刺激了除功能菌外的某些相似的土壤微生物,这些被刺激增长的土壤微生物可能会进一步影响土壤中微生物的相互作用且可能具有潜在的拮抗性,从而帮助减少植物病害[]。
施用复合菌剂是塑造土壤微生物群落组成的主要因素。就细菌属水平上微生物组成的变化而言,施用复合菌剂处理明显提高了放线菌门的大理石雕菌属Marmoricola、类诺卡氏菌属Nocardioides、野野村式菌属Nonomuraea和酸杆菌门的norank_c__Acidobacteria、norank_f__ Blastocatellaceae__Subgroup_4_、DS-100属相对丰度(),且这些属相对丰度与香蕉枯萎病病情指数显著负相关(),表明这些属可能对香蕉枯萎病的抑制有重要作用。已有研究表明大理石雕菌属Marmoricola、类诺卡氏菌属Nocardioides、野野村式菌属Nonomuraea能促进大豆、苜蓿等作物生物量的提高[],提高作物抵抗病害的能力。本研究结果中酸杆菌门Acidobacteria相对丰度与香蕉枯萎病病情指数呈显著负相关(),这与Sanguin等[]研究的抗病土壤有更高的酸杆菌门Acidobacteria丰度结果一致。本研究中酸杆菌门的norank_c__Acidobacteria、norank_f__ Blastocatellaceae__Subgroup_4_和DS-100属相对丰度与抗病性呈显著负相关(),但是它们的抗病机制尚不清楚。已有研究表明,芽孢杆菌属Bacillus能抑制某些作物的土传病害[],但是在本研究中,Bacillus相对丰度与香蕉枯萎病病情指数正相关(),这可能是因为土壤酶活性、土壤物理化学性质等土壤性质的改变会影响微生物群落,从而影响作物与有益微生物间的相互关系[]。施用复合菌剂也改变了真菌群落结构组成。本研究中,子囊菌门Ascomycota和结合菌门Zygomycota在所有样本中相对丰度最高())。此外,使用复合菌剂降低了子囊菌门Ascomycota相对丰度,且子囊菌门相对丰度与香蕉枯萎病病情指数显著正相关()。已有研究表明子囊菌门中包含一些致病菌[],且香蕉根际子囊菌门相对丰度的降低与抑制香蕉枯萎病关系密切[]。在真菌属水平上,施用复合菌剂显著提高了Gibellulopsis属相对丰度,且Gibellulopsis属相对丰度与香蕉枯萎病病情指数显著负相关(R=-0.769)()。Gibellulopsis是子囊菌门一个新提出的属[],尚无其与枯萎病关系的相关报道。本研究中施用复合菌剂降低了毛壳菌属Chaetomium和曲霉菌属Aspergillus相对丰度,且毛壳菌属和曲霉菌属相对丰度与香蕉枯萎病病情指数显著正相关()。据报道,毛壳菌属与棉花黄萎病发生程度呈正相关[]。且研究表明西瓜连作后,以曲霉菌属等为主的真菌数量大幅增加,导致连作西瓜易发病[]。
3.3 复合菌剂防治香蕉枯萎病的可能机制本文的研究结果表明,复合菌剂(NFP和NFPT)中的功能菌(non-pathogenic Fusarium oxysporum sp.,Paecilomyces sp.和Trichoderma sp.)在土壤中生存能力有限,对香蕉枯萎病病原菌直接的抑制作用很小,其抗病的机理可能为:引入土壤中的功能菌可能是作为关键群落成员,刺激了土著有益微生物中其他潜在的拮抗物种,增加了土壤微生物多样性,改变了土壤细菌和真菌群落结构,这种生物防治相互作用的复杂关系说明疾病抑制通常是一个复杂的现象,复杂的微生物群落可能对抑病有决定性作用[]。研究表明,在抗病性土壤中,因为非致病性尖孢镰刀菌和致病性尖孢镰刀菌的相互作用导致了土壤的抗病性; 非致病性尖孢镰刀菌和致病性尖孢镰刀菌区别在于,非致病性尖孢镰刀菌从根部侵入后并不会继续侵入维管系统导致植物发病[]。在接种病原菌前接种的非致病性尖孢镰刀菌(non-pathogenic Fusarium oxysporum sp.)可能会和病原菌抢占根表有限的侵染位点[]; 同时施入土壤中的木霉菌(Trichoderma sp.)因其强大的繁殖和养分吸收能力可能会使其与病原菌争夺有限的养分和空间[],制约了病原菌的生长与繁殖; 施入土壤中的生防真菌淡紫拟青霉菌(Paecilomyces sp.)对植物寄生的根结线虫有一定的生防效果,减少了根结线虫对植物根系的损伤[],从而减少了病原菌的侵染。这些机制相互作用,相互协同,对提高复合菌剂的生防效果可能有积极的促进作用。
本文中另一个想探讨的问题是接入土壤中的功能菌(non-pathogenic Fusarium oxysporum sp.,Paecilomyces sp.和Trichoderma sp.)是否会对香蕉枯萎病病原菌产生直接的抑制作用?尽管复合真菌制剂NFPT处理木霉属Trichoderma相对丰度较CK处理高()),但是木霉属相对丰度与香蕉枯萎病病情指数未达到显著的负相关()。此外,复合真菌制剂NFP处理拟青霉属Paecilomyces相对丰度在3个处理中最高()),但是Paecilomyces属相对丰度与香蕉枯萎病病情指数也未达到显著的负相关()。本研究中复合菌剂处理(NFP和NFPT)镰刀菌属相对丰度高于CK处理,但差异未达到显著水平()),镰刀菌属相对丰度与香蕉枯萎病病情指数呈负相关(未达到显著水平),且病原菌尖孢镰刀菌的qPCR分析结果表明复合真菌菌剂处理(NFP和NFPT)病原菌尖孢镰刀菌数量显著低于CK处理(),但是由于Illumina MiSeq平台测序长度的限制,测序结果不能在物种级别上进行详细的分类特征描述,因此难以区分致病性尖孢镰刀菌和非致病性尖孢镰刀菌。综上所述,本研究结果表明,引入土壤中的微生物(非致病性尖孢镰刀菌Non-pathogenic Fusarium oxysporum sp.、木霉菌Trichoderma sp.和淡紫拟青霉菌Paecilomyces sp.)在盆栽土壤中生存能力有限,并且它们的丰度对F. oxyporum丰度和防治香蕉枯萎病的直接影响很小,并不对病原菌产生直接的拮抗作用。
本试验通过两季的盆栽试验,利用对细菌16S rRNA基因和真菌ITS区域的高通量测序,研究了复合真菌制剂对香蕉枯萎病的防治效果及其机理。但是由于16S rRNA和ITS测序仅能开展在菌属层面的分析,因此,后续试验将通过宏基因组和转录组等分子生物学手段进一步探索影响香蕉枯萎病发生的关键菌种及其功能基因,为防治香蕉枯萎病提供理论依据。本研究所得结果基于盆栽试验,需要进一步在田间试验中验证,然后再应用于生产。
4 结论基于盆栽研究结果表明,施用复合真菌制剂显著降低了香蕉枯萎病的病情指数,能有效防治香蕉枯萎病; 施用复合真菌制剂提高了细菌和真菌丰富度和多样性,改变了细菌和真菌群落结构; 加入土壤中的生防真菌菌株在发挥其拮抗作用的同时刺激了土壤自身潜在的有益微生物种群,与之协同作用,提高了复合真菌制剂对香蕉枯萎病的防治效果。