
丁香假单胞菌(Pseudomonas syringae)是一种重要的革兰氏阴性细菌,接送孩子13825404095可导致番茄、大豆和烟草等多种经济作物病害[]。由该细菌引起的病害发展迅速、危害严重且在各地流行性发生,成为全球关注的病原细菌,其引起植物病害的发生率居十大植物细菌性病害之首[-]。丁香假单胞菌属于假单胞菌属,根据寄主及引发的症状不同可将其分为50多个致病变种[-]。该细菌能够侵染大部分植物的气生组织,通过伤口或气孔等自然孔口进入质外体,继而迅速繁殖,导致寄主植物出现坏死、黄化等症状[, ]。
丁香假单胞菌侵染寄主植物,通过分泌胞壁降解酶、毒素等物质破坏植物细胞的细胞壁、细胞膜等方式导致植物发病。当丁香假单胞菌进入植物组织的质外体后,通过Ⅲ型分泌系统(type Ⅲ secretion system,T3SS)将效应蛋白输入到寄主细胞中,抑制植物免疫反应的信号途径,从而逃避寄主植物的防御反应,以达到成功定殖[, ]。编码T3SS结构蛋白和效应分子的基因在侵染寄主植物早期阶段被诱导表达[-]。若无T3SS,病原菌便不能克服植物的基础抗性使其在植物体内定殖,反而会诱发寄主产生抗病反应[]。除了假单胞菌,T3SS在其他革兰氏阴性细菌中也存在,包括耶尔森氏菌、肠炎沙门氏菌、志贺氏菌和埃希氏大肠杆菌等[]。虽然革兰氏阴性细菌的T3SS在分子结构和转运机制上有许多相似之处,但是被转运的效应分子、T3SS基因的表达调控方式及致病机理却有很大差异[]。T3SS综合调控网络的解析对深入理解丁香假单胞菌的致病机理及研发新的靶标药物具有重要的科学意义。为此,本文在简要介绍丁香假单胞菌T3SS组成和功能的基础上,对T3SS表达调控的研究进展进行综述和讨论。
1 T3SS的组成及结构T3SS是存在于许多革兰氏阴性致病菌中的复杂分子装置,包括丁香假单胞菌、耶尔森氏菌、肠炎沙门氏菌、志贺氏菌和铜绿假单胞菌等[]。该装置类似于针状结构(needle complex,NC),主要由蛋白质组成,跨越细菌内膜、周质空间、肽聚糖层、细菌外膜、细胞外空间和寄主细胞膜,为效应物从细菌的细胞质进入寄主提供了一条连续且直接的途径[]。NC由一个延伸的螺旋结构(针)和跨越内外细菌膜和周质空间的基底组成,基底本身由两组同心圆环复合物组成,嵌在每一层膜中;其在细胞外分为3个主要部分:(1) “针”,它是由YscF家族特定蛋白的上百个拷贝组成的螺旋聚合物[];(2) 延伸区,由序列分化的蛋白组成;(3) 易位孔,由来自YopB和YopD家族的2个蛋白组成。据推测,这2个蛋白寡聚成寄主膜上的通道,是效应物进入寄主细胞所必需的通道[]。这些结构部件均通过基底体连接到细胞外空间,并起着蛋白质分泌装置的作用[]。T3SS在植物-病原互作中起重要作用[-],负责把效应蛋白等毒力因子输送到寄主细胞。丁香假单胞菌的T3SS由hrp和hrc基因簇的产物编码和调控,与许多T3SS效应基因聚集在一起,形成一个致病相关的岛[]。T3SS存在一个高度复杂的调控网络,其控制着丁香假单胞菌的致病性。细菌将T3SS针尖插入寄主细胞膜,通过接触依赖性转运将效应蛋白注入到寄主真核细胞内,使寄主细胞成为适宜侵染的环境[-]。
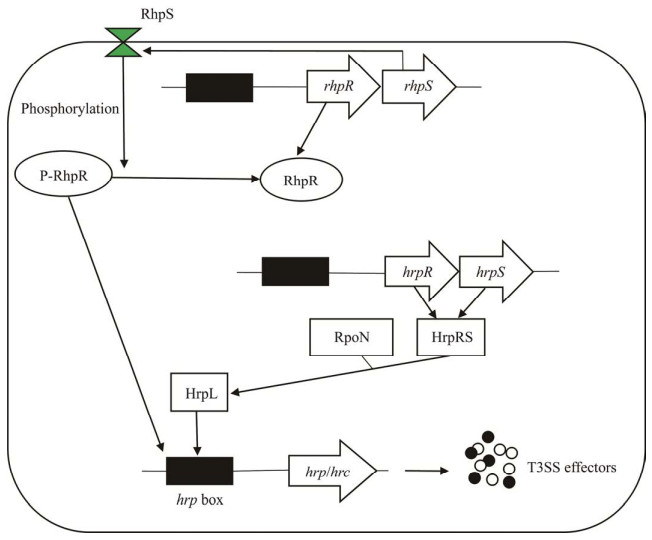
2 T3SS的激活假单胞菌、欧文氏菌和斯氏泛菌的大多数T3SS基因的表达主要由σ因子HrpL调控[, ]。丁香假单胞菌T3SS基因的表达可被HrpL在不同水平(包括转录、稳定性和活性)上激活,hrpL的诱导主要由HrpR/S控制,该调控因子与T3SS基因启动子中高度保守的hrp box (GGAACC-N15/16-CCACNNA)结合[, ]。hrpL的诱导需要σ因子rpoN (σ54)和2个转录激活因子HrpR和HrpS;hrpR和hrpS基因是相邻的,具有相同的启动子[]。一般来说,HrpR和HrpS作为一种异二聚体,HrpS即使在无HrpR的情况下也能诱导少量的hrpL表达[, ]。HrpR和HrpS依赖σ54因子进行转录调控[]。在T3SS诱导条件下,HrpR/S与hrpL启动子结合,在rpoN-RNA聚合酶的协助下激活hrpL转录,从而激活T3SS的表达[]。
除此之外,hrpL转录还受到其他胞内蛋白的影响。在aefR突变体中,T3SS基因的诱导表达减弱,细菌致病性降低,表明AefR是群体感应和T3SS的双功能调节因子[]。在DC3000菌株中,hrpL操纵子受双组分系统CorR/S调控[]。当丁香假单胞菌侵染寄主植物时,CorR/S通过控制冠状毒素的产生来诱导寄主细胞气孔的开闭[-]。CorR与hrpL上游区域结合,直接调控hrpL基因的早期转录[]。在DC3000菌株的psrA突变体中,hrpL转录水平降低,侵染番茄叶片的毒力减弱,这表明psrA突变对hrpL的表达有正调控作用[]。有研究表明,一种脂蛋白HrpT能够以不依赖环境的方式抑制hrpL的表达[]。
3 T3SS的主要调控因子RhpR/S双组分系统是一种信号转导系统,至少由两种蛋白组成,即负责感知外部刺激的传感器激酶和反应调节因子,是细菌适应外界环境变化的一种机制[]。丁香假单胞菌的双组分系统RhpR/S直接调控hrpR/S和其他与毒力相关的通路,并在T3SS的调控网络中发挥关键作用,是参与T3SS调控的主要因子[]。在富营养的条件下,RhpR被RhpS磷酸化,直接抑制hrpR/S-hrpL-T3SS级联反应[-]。RhpR/S直接调控hrp/hrc基因的启动子区域[]。植物病原细菌的hrp基因簇可分为两个类群:一类hrp基因来自P. syringae、Erwinia spp.和Pantoea stewartii;另一类hrp基因来自Ralstonia solanacearum和Xanthomonas spp.[]。一般来说,同一类群的hrp基因在其调控系统中具有相似的机制,它们在诱导非寄主植物的过敏性反应和引起寄主植物发病中发挥着重要作用[, ]。研究表明,双组分系统(RhpR/S、CvsR/S和GacA/S)与AlgU和HrpA共同调控hrpR/S的mRNA水平,HrpG和HrpV是HrpR/S转录后重要的调控因子[],这些因子都直接或间接参与了丁香假单胞菌T3SS的调控网络和途径。双组分系统在其他植物病原细菌的致病性中也具有重要作用。如在水稻条斑病菌中,RpfC/G双组分系统通过降解c-di-GMP促进胞外多糖、生物膜等的转录表达,进而影响细菌的毒力[]。
3.1 转录因子HrpR/S转录因子是由基因编码的一类蛋白质,能够与基因启动子区域中的顺式作用元件发生特异性作用,其功能是通过它们之间以及与其他相关蛋白之间的相互作用来激活或抑制某些基因的转录水平,从而改变细胞生理状态[-]。丁香假单胞菌的转录因子HrpR和HrpS通过在hrpL启动子处激活σ54依赖的转录来激活T3SS参与的毒性[]。HrpS是HrpRS复合物的重要组成部分,是控制T3SS基因表达的关键转录因子,其能单独调控细菌T3SS的表达、运动性和生物膜的形成[-]。硫代烷能直接修饰HrpS蛋白,从而抑制细菌T3SS表达和毒力[, , ]。hrpR的启动子和编码序列保守,只有hrpR激活才能使hrp调节子的转录水平提高[]。HrpS作为同源低聚体激活转录,与HrpR直接作用形成一种高度依赖的异六聚体复合物,触发T3SS参与的毒性[, ]。hrpR和hrpS串联排列,转录为单一的操纵子,并表现出高度的序列相似性,因此它们很可能由共同的原始基因进化成相互依赖的复合体[, ]。
HrpR和HrpS是T3SS表达的正向调控因子,它们均是增强子结合蛋白家族(EPS)中的成员[-],通常作为双组分系统的反应调节因子[]。大多数增强子结合蛋白是模块化的,由调节接收结构域(AB)、与σ54相互作用的中心结构域(C)及与增强子或上游激活区结合的结构域(D)组成[-]。与其他增强子结合蛋白类似,HrpR和HrpS保留了与σ54相互作用的中心结构域(C)和DNA结合域(D)[-],但不同于大多数在双组分系统中发挥作用的增强结合子,原因在于它们明显缺乏受体域,而受体域在响应磷酸化调节中发挥作用[, ]。虽然HrpR和HrpS协同调控hrpL,但它们也有各自的调控特点。HrpS与其他胞内蛋白相互作用,而HrpR倾向与核苷酸结合来发挥作用[]。HrpS单独激活T3SS效应基因hopAJ1和hrp (hrpK1和hrpA2) 的转录,表明其在T3SS级联调控中的核心作用[, ]。也有研究表明,HrpS可以独立于HrpR来激活丁香假单胞菌hrp基因的表达[]。T3SS诱导环境中,在σ54因子RpoN的帮助下,HrpR与HrpS形成异源二聚体,直接激活T3SS的转录[]。
3.2 hrpR/S操纵子的诱导受RhpR/S的调控双组分系统使微生物能够感知并对环境刺激做出反应,典型的双组分系统包括感知胞外信号的组氨酸激酶和调控下游基因表达的同源反应调节因子[-]。hrpR/S操纵子的转录受双组分系统RhpR/S的调控[]。组氨酸激酶RhpS负责感知外部营养条件的变化,直接抑制下游hrpR/S操纵子的转录,进而调控RhpR[, , ]。rhpR和rhpS位于同一个操纵子中,其中rhpR基因编码反应调节因子,而rhpS编码同源的感应激酶[]。在T3SS诱导条件下(植物组织内或MM培养基),rhpS的缺失可显著降低T3SS基因的表达,从而抑制非寄主植物的过敏性反应以及对寄主植物的致病性[]。此外,rhpR/S双突变体与野生型菌株具有类似的hrpR/S诱导水平和毒性,表明RhpR具有负调控hrpR/S的作用[]。
RhpR的磷酸化位点D70在负调控T3SS基因表达中至关重要[]。磷酸化的RhpR控制多种与细菌毒力相关的表型,包括T3SS、运动性、c-di-GMP水平、脂多糖和生物膜的形成等[]。RhpS磷酸化后优先与携带反向重复基元(GTATC-N6-GATAC)的区域(包括自身的启动子区域)结合[, ]。研究发现,RhpR可直接与hrpR/S上游区域的5'端不完全反向重复基元结合,表明其直接调控hrpRS-hrpL-T3SS的级联反应[]。
4 HrpR/S异质二聚体的组装HrpG和HrpV是HrpRS转录后重要的调控因子,在丁香假单胞菌中,hrpG和hrpV基因位于同一个操纵子上;在T3SS诱导培养基中,hrpV负调控T3SS[]。HrpV直接与HrpS中的AAA+结构域结合,干扰HrpR/S异质二聚体的形成,进而影响T3SS基因的表达[]。相反地,HrpG可以阻断过表达的hrpv对T3SS基因的抑制[]。T3SS的2个伴侣蛋白HrpJ和HrpF也参与了HrpR/S/V/G的调控[-]。HrpJ直接与HrpGV异二聚体结合形成1:1:1的HrpGVJ三联体,并附着在细菌膜上,可能是通过阻止HrpGV接触DNA,从而负调控T3SS基因的表达[]。此外,HrpF可直接与HrpG蛋白结合,通过HrpR/S/V/G途径对T3SS起负调控作用[]。
5 T3SS的其他调控因子GacA/S是参与调控T3SS高度保守的双组分系统,是不同病原细菌毒力性状的重要调控因子,包括丁香假单胞菌和铜绿假单胞菌等[]。膜结合的传感器激酶GacS能被环境信号激活,使细胞质内的反应调节子GacA磷酸化,磷酸化的GacA蛋白结合sRNA基因RsmX、RsmY和RsmZ的启动子区域,进而促进它们的转录[]。在丁香假单胞菌中,GacA/S作为与细菌毒力性状相关的主调控因子,调控了T3SS的表达、毒素产生和运动性[, ]。GacA是丁香假单胞菌T3SS的负调节因子,gacA基因的突变可导致hrpRS和hrpL的诱导水平减弱,进而导致细菌毒性降低[, ]。我们课题组前期研究发现,gacA突变后可导致细菌的游动性、胞外多糖的产生和生物膜的形成减弱,也可以引起烟草的过敏性反应减弱[]。此外,有研究发现GacA也影响了丁香假单胞菌群体感应信号N-acyl-homoserine的生物合成[]。
CvsR/S双组分系统的诱导依赖环境中的Ca2+浓度,这是丁香假单胞菌发挥毒性的必要条件;CvsR直接激活T3SS调节基因hrpR和hrpS的表达,通过T3SS控制细菌的毒力[]。AlgU是一种胞外功能因子,其能调节藻酸盐的产生以及对环境胁迫的抗性[]。研究表明,AlgU上调了T3SS基因hrpR/S、hrpL、hrpV和其他效应基因的表达,而且可以直接诱导hrpR/S的表达[]。hrpA是HrpL的调控基因,能被可溶性的植物细胞信号诱导[-]。研究表明,HrpA上调了hrpR/S操纵子的表达[]。
Lon蛋白酶是ATP依赖的一种高度保守的多功能酶,能够降解失去活性的蛋白[]。在丁香假单胞菌中,Lon蛋白酶能够靶向并切割HrpR蛋白,但不能切割HrpS蛋白,其负调控T3SS的表达[]。在梨火疫病菌中,lon基因突变也导致T3SS的表达上调[],但在铜绿假单胞菌中,lon基因突变下调了T3SS相关基因的表达[]。除此之外,Lon还参与了RhpR/S介导的T3SS调控[],同时其也可以作为蛋白酶参与丁香假单胞菌的代谢[]。最近的一项研究发现,在丁香假单胞NPS3121菌株的rhpC突变体中T3SS的表达降低:在丁香假单胞菌的基因组中,rhpC位于rhpP的下游,共同组成rhpPC操纵子;在缺失rhpC时,RhpP蛋白酶影响了HrpL的积累,从而抑制T3SS基因的表达[]。
细菌的第二信使分子负责感知传递胞外信号和控制各种细胞进程,使细菌能适应复杂的外界环境,这对细菌生存尤为重要[-]。鸟苷四/五磷酸(p)ppGpp和环二鸟苷酸c-di-GMP作为第二信使分子被证实能够调节丁香假单胞菌T3SS的级联反应;在丁香假单胞菌中,(p)ppGpp调控了多个毒力相关的通路,如T3SS的表达、铁载体的产生、抗逆性、运动性和细胞形态[]。c-di-GMP调节许多细菌生物膜的形成以及通过负调控T3SS的表达影响细菌毒力等[, ]。在黄单胞菌中,环二鸟苷酸c-di-GMP水平降低会导致EPS和胞外酶类的产量增多,T3SS的表达上调,进而导致病原细菌致病性降低[]。
环境对微生物病原菌的侵染也至关重要。与野生型拟南芥相比,缺乏att1基因的拟南芥突变体接种P. syringae pv. tomato后,avrPto和hrpL的表达升高;att1基因编码一种催化脂肪酸氧化的酶CYP86A2,这一结果表明,寄主植物合成的脂肪酸可能会抑制细菌T3SS基因的表达[]。在DC3000菌株中,hrpK的表达在番茄渗出液中被激活,说明可溶性低分子量植物信号参与了T3SS基因的诱导[]。丁香假单胞菌的T3SS表达在富营养的条件下被抑制,而在营养胁迫的条件下被诱导,说明T3SS不仅受内源因素的控制,而且也受外部信号的影响[]。多项研究表明,T3SS还受pH、碳源、氮源、有机酸、温度和渗透压等一系列环境因素的影响[]。在DC3000菌株中,果糖能有效诱导hrpRS的表达,hrpL和几个T3SS效应基因在低细胞密度下也能被一些有机酸和糖(如蔗糖、葡萄糖、甘露醇和琥珀酸)显著激活[]。在番茄中,己酸可以用来防御丁香假单胞菌的侵染[]。然而,在高浓度的己酸下,avrPtoB和hrpL的表达却上调。这种结果可能是由于过量己酸引起了非生物胁迫,同时也说明T3SS在细菌的生存和适应性中发挥重要作用[]。
T3SS具有复杂的结构和功能,细菌通过复杂的T3SS网络以快速响应外部环境的变化来实现成功入侵寄主,从而使得病菌流行性传播。目前学者们对丁香假单胞菌T3SS的组成与结构及调控机制等方面进行了较多研究,并取得了重要的进展,但仍存在许多问题亟待解决。例如,T3SS不仅受细胞内调控因子的影响,同时也受外界环境信号和寄主因素等的调控。双组分系统RhpRS是T3SS的关键开关,并鉴定发现了其他调节T3SS的信号转导系统[],但细菌如何感应环境信号并做出相应反应的机制还知之甚少。双组分系统主要负责感知外界信号,其在阐明环境寄主信号和T3SS调控互作关系过程中扮演着关键角色,然而对于引发或抑制T3SS的环境和寄主信号分子仍不清楚。因此,双组分系统信号途径或将成为控制丁香假单胞菌的主要靶标。设计靶向药物阻断信号转导途径或干扰关键蛋白的正常功能,可有望干扰细菌的毒性等生物学功能。此外,我们仍未完全清楚T3SS综合调控网络和特定的分子机制。T3SS综合调控网络的解析有助于全面理解丁香假单胞菌T3SS的调控机制,有利于发现抑制细菌侵染的分子靶标。筛选和鉴定与T3SS调控相关的关键基因,并以此来设计靶向药物,并将环境与寄主信号的调控途径进行联系,构建出完整而全面的调控网络系统,这不仅有助于更好地了解这种细菌,也将有助于寻找生态友好和可持续的方法来控制丁香假单胞菌引起的病害。