

![]()
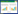
![]()
引用本文
黄建凤, 张发宝, 逄玉万, 黄巧义, 唐拴虎, 付弘婷, 杨苞梅. 两株香蕉枯萎病拮抗细菌的筛选及抑菌机理[J]. 微生物学通报, 2017, 44(4): 835-844.

HUANG Jian-Feng, ZHANG Fa-Bao, PANG Yu-Wan, HUANG Qiao-Yi, TANG Shuan-Hu, FU Hong-Ting, YANG Bao-Mei. Inhibition of banana Fusarium wilt by two biocontrol agents[J]. Microbiology China, 2017, 44(4): 835-844.

两株香蕉枯萎病拮抗细菌的筛选及抑菌机理
黄建凤, 张发宝


广东省农业科学院农业资源与环境研究所 农业部南方植物营养与肥料重点实验室 广东省养分资源循环利用与耕地保育重点实验室 广东 广州 510640
收稿日期: 2016-05-09; 接受日期: 2016-10-08; 优先数字出版日期(): 2016-11-08
基金项目: 广东省科技计划项目 (No. 2015A020209053,家电清洗138254040952015A020209061,2015B020237007)
*通讯作者: 张发宝, Tel:86-20-85161460;E-mail:fabaozhang@163.com
摘要: 【目的】 从发病蕉园中的健康香蕉根际筛选能有效抑制香蕉枯萎病病原菌生长的拮抗菌,进一步研究其抑菌机理。 【方法】 应用双层平板初筛和平板对峙实验复筛具有抑菌效果的拮抗菌;经生理生化试验、16S rRNA基因测序和特异引物扩增对拮抗菌进行鉴定;酸沉淀方法提取拮抗菌发酵液抑菌物质粗提液,基于比色法和HPLC测定粗提液对菌丝蛋白质含量、脂质过氧化、麦角甾醇和果胶酶活性的影响。 【结果】 筛选获得两株拮抗细菌H-2和H-7,初步鉴定为枯草芽孢杆菌和解淀粉芽孢杆菌,GenBank登录号分别为KX791428和KX791430;温室盆栽试验显示,两株拮抗菌对香蕉枯萎病的生防效率分别为59.1%和53.0%;H-2和H-7粗提液处理病原菌菌丝后,因脂质过氧化产生的丙二醛含量显著增加,分别达0.55 μmol/L和0.48 μmol/L;而蛋白含量、麦角甾醇含量和果胶酶活性均显著下降,其中H-2处理的抑制幅度更大,三项指标分别为0.15 mg/g、1.31 mg/g和0.008 7 U/mL,显著低于对照的0.25 mg/g、1.96 mg/g和0.035 U/mL。 【结论】 从健康香蕉根际筛选到两株拮抗细菌,两者可能通过增强病原菌菌丝的脂质过氧化和降低细胞代谢产物合成的方式抑制病原菌生长,可为两株拮抗菌的生防应用提供理论依据。
关键词: 香蕉枯萎病 拮抗菌 筛选 抑菌机理
Inhibition of banana Fusarium wilt by two biocontrol agents
HUANG Jian-Feng, ZHANG Fa-Bao


Institute of Agricultural Resources and Environment, Guangdong Academy of Agricultural Sciences, Key Laboratory of Plant Nutrition and Fertilizer in South Region, Guangdong Key Laboratory of Nutrient Cycling and Farmland Conservation, Guangzhou, Guangdong 510640, China
Received: May 09, 2016; Accepted: October 08, 2016; Published online(): November 08, 2016
Foundation item: Science and Technology Planning Project of Guangdong Province (No. 2015A020209053, 2015A020209061, 2015B020237007)
*Corresponding author: ZHANG Fa-Bao, Tel: 86-20-85161460; E-mail: fabaozhang@163.com.
Abstract: [Objective] To screen effective biocontrol agents from healthy banana rhizosphere in a diseased field and further study the inhibition mechanism. [Methods] Double-deck plates and fermentation antagonism study were used as primary-and secondary-screening for antagonists. Observing strains were identified based on physiological and biochemical tests, 16S rRNA gene sequencing and specific gene amplification. Crude extracts of fermentation were observed by using acid precipitate method and then added to the fermentation of pathogen for 5 days. Concentration of protein, malondialdehyde (MDA), ergosterol and pectinase activities were analyzed based on colorimetric method and HPLC to find out the effect of antagonists crude extracts on the growth of pathogen. [Results] Two antagonists, named as H-2 and H-7, were observed and identified as Bacillus subtilis (GenBank: KX791428) and Bacillus amyloliquefaciens (GenBank: KX791430), respectively. Fusarium wilt of banana was suppressed by these two strains and the biocontrol efficacies were 59.1% and 53.0%, respectively, based on the greenhouse condition. Concentration of MDA was significantly increased to 0.55 μmol/L and 0.48 μmol/L by treating the pathogen hyphae with suspension of H-2 and H-7, respectively. Meanwhile, concentration of protein, ergosterol and pectinase activities were significantly decreased in both H-2 and H-7 treatments and the lower index values were observed by H-2 by showing as 0.15 mg/g, 1.31 mg/g and 0.008 7 U/mL, respectively, which were significantly lower than those of CK (0.25 mg/g, 1.96 mg/g and 0.035 U/mL). [Conclusion] In conclusion, two antagonists screened from healthy banana rhizosphere soil were able to inhibit the growth of pathogen by increasing the lipid peroxidation of pathogen hyphae and decreasing the synthesis of metabolism products, which provide theoretical basis on the biocontrol application of two antagonists.
Key words: Fusarium wilt of banana Antagonistic strain Screening Inhibition mechanism
香蕉枯萎病是由尖孢镰刀菌 (Fusarium oxysporum f. sp. cubense) 侵染而引起维管束坏死的毁灭性土传真菌病害,该病会导致植物茎叶萎蔫甚至全部枯死,一旦暴发则难以遏制,严重影响了香蕉产业的发展,有关该病害的防控研究已迫在眉睫[-]。已报道的香蕉枯萎病防控方法包括化学防治、抗病品种培育、农业防控措施及生物防控等,前3种措施存在污染环境、成本较高和防效不稳定等问题[-],而生物防控具有环境友好型特点,是目前公认比较安全和有效的防控措施。生物防控的基础在于筛选高效的生防菌株,已有很多研究报道筛选到能防控枯萎病发生的生防菌,包括放线菌、芽孢杆菌、假单胞菌、木霉和非致病力尖孢镰刀菌等[-]。我国在香蕉枯萎病防控研究方面起步较晚,现有的生防菌资源库有限,且有些菌株在实际应用过程中常发生变异和退化现象[],需要不断补充新的高效生防菌株。本研究拟从发病蕉园健康香蕉根际土中筛选高效生防菌株,以丰富现有的生防菌种资源库,为有效防控香蕉枯萎病奠定基础。
生防菌的生防机制主要包括竞争作用、拮抗作用和诱导植株产生抗性等。其中,拮抗作用是生防的主要机制,生防菌代谢产生的拮抗物质主要包括细胞壁降解酶类,如几丁质酶或葡聚糖酶、抗菌蛋白、抗菌肽和挥发性物质等[-]。于杰等[]研究表明,枯草芽孢杆菌B25代谢产生的抗菌蛋白可使尖孢镰刀菌菌丝或孢子肿大、扭曲或畸形,并可清晰看见其内含物,病原菌的生长繁殖受到抑制。有关这些抑制作用产生的毒理效应研究已有少量报道,王芳[]研究表明内生枯草芽孢杆菌抗菌物质与病原菌细胞膜上的卵磷脂类物质结合形成复合体导致膜的穿孔,从而破坏串珠镰刀菌质膜。刘先宝等[]则发现,生防菌代谢抑菌物质可有效破坏病原菌细胞膜并影响其代谢活动。本研究从病原菌菌丝脂质过氧化强度、蛋白含量、麦角甾醇含量和果胶酶活性几方面分析评价筛选获得的拮抗菌代谢产生的拮抗物质粗提物对香蕉枯萎病病原菌的抑菌机理,为拮抗菌的后续应用提供理论基础。
1 材料与方法 1.1 试验材料 1.1.1 土壤样品: 筛菌土壤样品采自广东省惠州市博罗县某染病蕉园中健康香蕉植株根际,在香蕉根际周围挑选3个采样点取土,将采集的土壤装入自封袋中充分混匀,带回实验室备用。 1.1.2 培养基、主要试剂和仪器: 初筛培养基为双层平板[]:取已长满香蕉枯萎病病原菌的平板,在超净工作台操作,加入10 mL无菌水,将平板中的病原菌刮入90 mL带有玻璃珠的无菌水中,28、170 r/min振荡培养20 min,随后用双层无菌纱布过滤菌液,制成病原菌的孢子悬液 (浓度为105 CFU/mL)。取1 mL孢子悬液加到冷却至45-55的250 mL PDA培养基[]中,混匀后倒平板,待PDA平板冷却凝固后,再倒入冷却至45-55的牛肉膏培养基,制成双层平板。病原菌生长培养基为PDA培养基,拮抗菌纯化及生长培养基为牛肉膏培养基[]。拮抗菌产抑菌物质发酵培养基参照Jourdan等的配方[]。HBI微生物生化鉴定条购自青岛海博生物技术有限公司;DNA提取试剂盒购自天根生化科技 (北京) 有限公司;PCR扩增引物均由上海英潍捷基贸易有限公司合成;牛血清蛋白、麦角甾醇、硫代巴比妥酸和几丁质等试剂购自北京鼎国昌盛生物技术有限责任公司。大型恒温振荡器购自上海一恒科学仪器有限公司;培养箱购自广州市源起生物科技有限公司;PCR扩增仪购自Bio-Rad公司;病原菌脂质过氧化、蛋白质含量、果胶酶活性和麦角甾醇含量检测所用的分光光度计购自岛津仪器 (苏州) 有限公司。
1.2 拮抗菌的筛选 1.2.1 初筛: 将1.1.2的双层平板置于培养箱中,28培养1 d后取出,将采回的土样进行梯度稀释,并取10-3-10-6梯度的稀释液涂布于双层平板上,28倒置培养3-4 d,挑选出对病原菌有拮抗作用的菌株。 1.2.2 复筛: 采用平板对峙试验方法:用打孔器 (直径5 mm) 挖取病原菌菌块,将其放置于PDA平板中央,28培养箱中培养1 d后,在距病原菌块四周2.5 cm处点接待测菌株,28再培养3-5 d后观察待测菌株对病原菌的抑制情况。 1.3 拮抗菌发酵上清液抑菌效果测定采用牛津杯法检测,将筛选到的拮抗菌接入新鲜的发酵培养基中,30、170 r/min摇床培养48 h后,10 000 r/min离心5 min,收集上清液,用无菌滤膜 (直径0.22 μm) 过滤除菌后获得无菌上清液备用。用打孔器 (直径5 mm) 挖取病原菌菌块,将其放置于PDA平板中央,28培养箱中培养1 d后,在距病原菌块四周2.5 cm处放置无菌牛津杯,每个牛津杯中加入200 μL无菌上清液,置于28培养箱中培养4-5 d后记录病原菌受抑制情况。
1.4 拮抗菌的鉴定 1.4.1 拮抗菌的生理生化鉴定: 采用HBI微生物生化鉴定条 (海博生物技术有限公司,青岛) 进行拮抗菌生理生化鉴定,共15项指标。菌株革兰氏染色参照《常见细菌鉴定手册》进行。 1.4.2 拮抗菌的16S rRNA基因鉴定: 拮抗菌DNA提取采用试剂盒提取方法,所用试剂盒由天根生化科技有限公司提供。菌株16S rRNA基因片段采用PCR扩增,所用引物由上海英潍捷基贸易有限公司合成,引物序列为:27f:5′-AGAGTTTGATCCTGGC TCAG-3′;1492r:5′-GGTTACCTTGTTACGACTT-3′。PCR反应体系 (50 μL):2.5 mmol/L dNTPs 4 μL,10×buffer 5 μL,25 mmol/L MgCl2 5 μL,模板DNA 1 μL,10 μmol/L引物各1 μL,5 U/μL Taq酶0.5 μL,双蒸水32.5 μL。PCR扩增条件:94;94 30 s,52,72,30个循环;72 10 min。PCR产物经琼脂糖凝胶电泳检测合格后送样测序,测序由上海英潍捷基贸易有限公司完成,所得测序结果上传NCBI与GenBank中的序列进行Blast比对分析,应用软件Mega 6.0构建菌株的系统发育树。 1.4.3 拮抗菌特异引物扩增: 拮抗菌DNA提取按照1.4.2方法;所用枯草芽孢杆菌和解淀粉芽孢杆菌的特异引物及其序列分别为:BSL72/BSR328 (5′-CGTAGAGCCACTTGAGCG-3′/5′-CTGCCGTTACAGTTCCTT-3′) 和L100/R836 (5′-AAATCTGCC CGTATCGTCG-3′/5′-GCGTCACGGCGR (AG) ATCTCAA-3′),目标产物长度分别为256和736 bp,检测的目的基因分别为rpoA基因和gyrA基因,引物序列及PCR体系和条件参照曹凤明等[]的方法。扩增产物进行1%琼脂糖凝胶电泳检测,每个样品每个基因重复2次。 1.5 拮抗菌对香蕉枯萎病的温室防控效果试验供试土壤为从未种植过香蕉的健康土,供试香蕉苗品种为巴西蕉,由广东省农业科学院果树研究所提供。试验共设3个处理:CK,只接种病原菌;H-2,接种病原菌和拮抗菌H-2;H-7,接种病原菌和拮抗菌H-7。移苗7 d后,采用灌根法接种病原菌,调节初始浓度为1.0×105 CFU/g干土;第二天分别接种两株拮抗菌,调节初始浓度为1.0×107 CFU/g干土。每个处理共10盆,每盆种植1株苗,共30盆,随机排列摆放于温室中,常规水肥管理,每天记录香蕉发病情况。试验周期为2016年4月至6月,持续50 d。
1.6 拮抗菌抑菌物质粗提物对病原菌生长和代谢的影响 1.6.1 拮抗菌抑菌物质的粗提: 按照1.3方法收集拮抗菌发酵上清液,用6 mol/L HCl将上清液的pH调至2.0,置于4沉淀过夜,取出8 000 r/min离心20 min,收集沉淀,将上清液的pH调回初始值 (pH 7.0),用分析纯的甲醇溶解沉淀,再次置于4 4 h,取出后8 000 r/min离心20 min,保留上清液。用牛津杯法检测提取上清液和酸沉淀的抑菌活性。 1.6.2 病原菌菌丝处理方法: 将病原菌分生孢子悬浮液接种于50 mL PDA液体培养基中,于28摇床培养5 d,分生孢子最终浓度为1×107 CFU/mL;加入1.6.1提取的拮抗菌抑菌物质,使其终浓度分别为100 mg/L,28静置培养5 d,备用。 1.6.3 粗提物对病原菌脂质过氧化的影响: 测定方法参照赵世杰等[]的方法。 1.6.4 粗提物对病原菌菌丝蛋白质含量的影响: 测定方法参照何璐[]的方法。 1.6.5 粗提物对病原菌菌丝果胶酶活性的影响: 测定方法参照何璐[]的方法。 1.6.6 粗提物对病原菌麦角甾醇含量的影响: 测定方法参照韩平等[]的方法。 1.7 数据分析数据统计和分析所用软件包括Excel 2007、SigmaPlot 12.5和Mega 6.0。
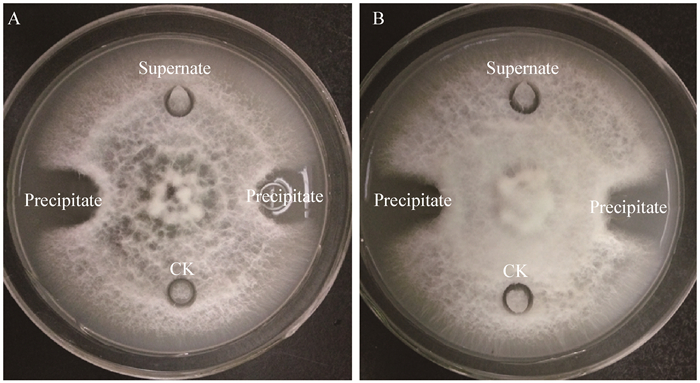
2 结果与分析 2.1 拮抗菌的分离与筛选经双层平板初筛后,共有8株细菌对病原菌产生抑菌圈,经挑取单菌落多次划线纯化后,根据菌落形态挑选5株拮抗菌进行复筛,经检测5株菌的发酵上清液拮抗效果后,编号分别为H-2和H-7的拮抗菌菌体及发酵液均对病原菌有平板拮抗作用 ()。
经生理生化指标鉴定,拮抗菌H-2和H-7均为革兰氏阳性细菌,硫化氢、脲酶、甘露醇、山梨醇和鼠李糖反应为阴性,其余各项指标反应为阳性 ()。
表 1 拮抗菌H-2和H-7的生理生化鉴定结果 Table 1 Physiological and biochemical characteristics of antagonists H-2 and H-7
特征Characteristics
H-2
H-7
ONPG
+
+
柠檬酸Citrate
+
+
硫化氢Hydrogen sulfide
-
-
脲酶Urease
-
-
乳糖Lactose
+
+
V-P
+
+
明胶Gelatine
+
+
葡萄糖Glucose
+
+
甘露醇Mannitol
-
-
山梨醇Sorbitol
-
-
鼠李糖Rhamnose
-
-
蔗糖Sucrose
+
+
蜜二糖Melibiose
+
+
阿拉伯糖Arabinose
+
+
革兰氏染色Gram stain
+
+
注:+:阳性反应;-:阴性反应.
Note: +: Positive effect; -: Negative effect.
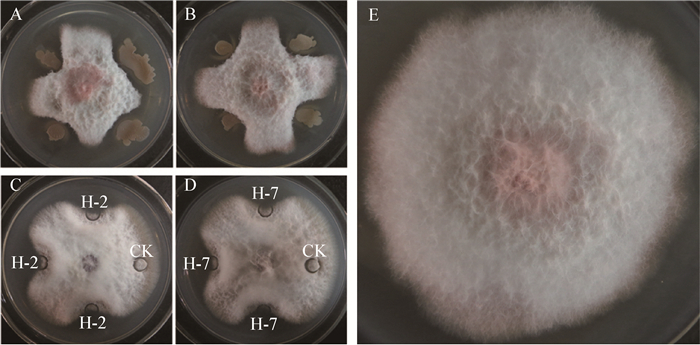
拮抗菌H-2和H-7的16S rRNA基因扩增产物测序,两者16S rRNA基因序列长度分别为1 454 bp和1 422 bp,上传至NCBI进行比对并调取相似性高的序列,应用Mega 6.0软件中的Neighbor-Joining分析方法构建系统发育树。经鉴定 (),拮抗菌H-2与枯草芽孢杆菌Bacillus subtilis U1PB1 (JQ308580) 处在同一分支,NCBI比对相似性为99% ();拮抗菌H-7与解淀粉芽孢杆菌Bacillus amyloliquefaciens Rx-34分支距离最近,NCBI比对相似性为99% ()。拮抗菌H-2和H-7的Genbank登录号分别为KX791428和KX791430。
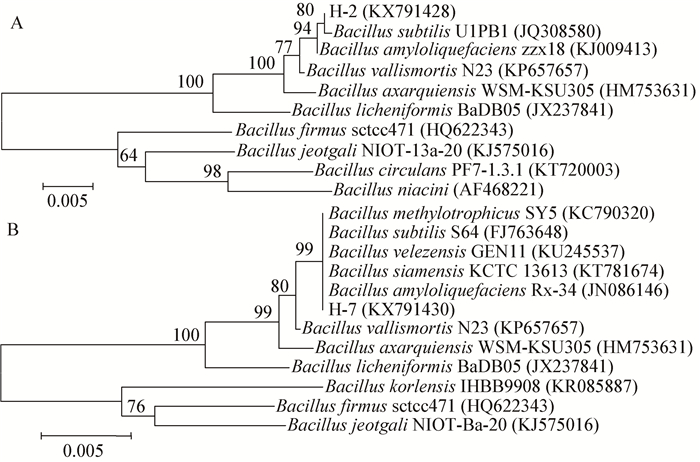
对拮抗菌H-2和H-7的特异引物进行扩增,结果显示 (),拮抗菌H-2在枯草芽孢杆菌特异引物rpoA基因目标片段处出现条带,而拮抗菌H-7则无相关片段。gyrA是解淀粉芽孢杆菌特异引物,扩增结果显示,拮抗菌H-7能扩增出相应目标片段,而H-2则未能扩增出相应片段。结合2.1和2.2的鉴定结果,可鉴定拮抗菌H-2和H-7分别为枯草芽孢杆菌Bacillus subtilis和解淀粉芽孢杆菌Bacillus amyloliquefaciens。
经酸沉淀提取,拮抗菌H-2和H-7的发酵液粗提物对香蕉枯萎病病原菌均有抑制效果 (),其中拮抗菌H-2的粗提物抑菌效果 () 略高于拮抗菌H-7 ()。表明酸沉淀方法可有效提取出两株拮抗菌发酵液代谢产生的拮抗物质,有利于后续研究的应用。
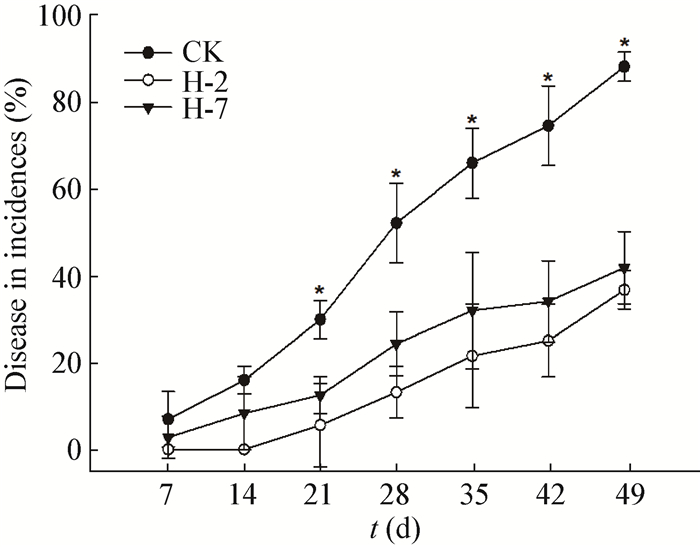
接种拮抗菌H-2和H-7可有效降低香蕉植株的发病率 ()。盆栽试验共持续50 d,处理2周后香蕉开始出现发病症状,至试验结束时,对照处理CK的发病率达89.7%,H-2和H-7处理的发病率分别为36.7%和42.2%,均显著低于对照 (P < 0.05),两者的生防效率分别为59.1%和53.0%。此外,整个试验过程中,处理H-2的植株发病率均低于H-7处理。
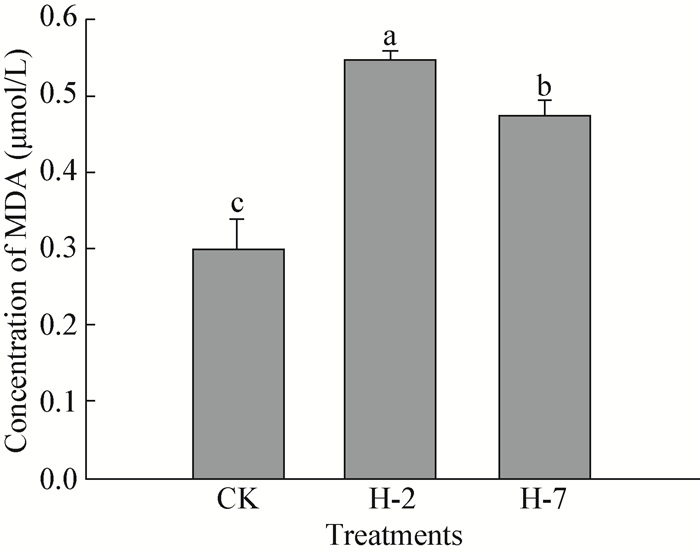
经拮抗菌H-2和H-7抑菌物质粗提物处理后,病原菌菌丝MDA含量均显著高于对照 (P < 0.05) (),其中,拮抗菌H-2的影响效果更强,显著高于H-7处理,前者处理后MDA含量为0.55 μmol/L,而后者为0.48 μmol/L,两者显著高于对照的0.30 μmol/L。丙二醛 (MDA) 是细胞膜脂质过氧化的产物,其含量高低表示细胞膜受损害程度大小,本研究结果显示,拮抗菌H-2和H-7的抑菌物质粗提物均能显著损伤病原菌细胞膜,可能是拮抗菌抑制病原菌生长的机理之一。
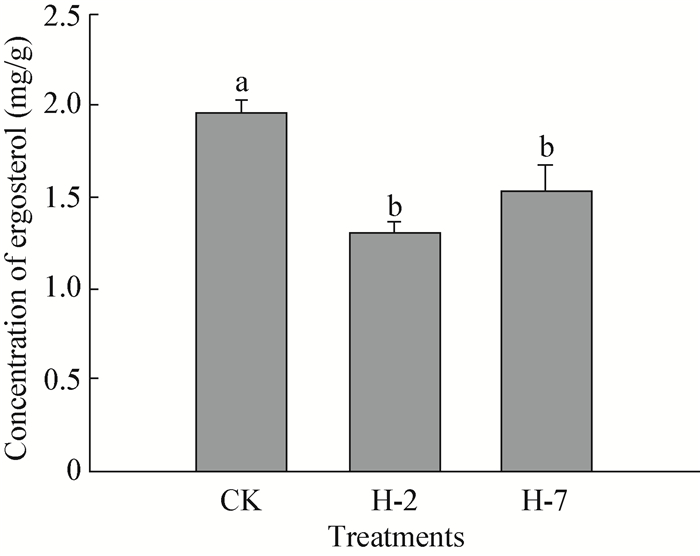
拮抗菌H-2和H-7的抑菌物质粗提物显著降低了病原菌麦角甾醇含量 (P < 0.05) (),其中,H-2处理的下降幅度高于H-7,试验结束时,对照处理病原菌麦角甾醇含量为1.96 mg/g,而H-2和H-7处理的含量分别为1.31 mg/g和1.53 mg/g。麦角甾醇是菌体细胞膜上重要的组成物质,该物质含量的减少表明细胞膜受到损伤,H-2和H-7均能显著降低该物质含量,表明两株菌可能通过损伤病原菌细胞膜来抑制其生长,可作为抑菌机理之一。
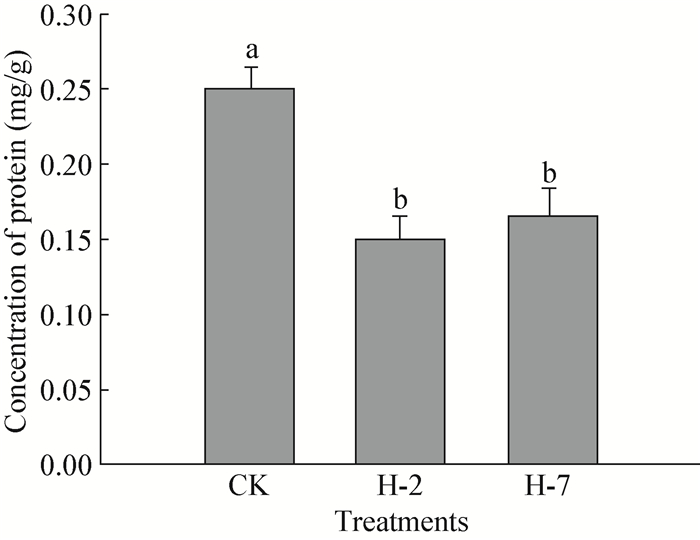
拮抗菌H-2和H-7的抑菌物质粗提物显著降低了病原菌蛋白质含量 (P < 0.05) (),试验结束时,对照处理病原菌蛋白质含量为0.25 mg/g,而H-2和H-7处理的含量分别为0.15 mg/g和0.17 mg/g。蛋白质是病原菌菌体细胞内代谢合成产物,该物质产量减少表明病原菌代谢活性减弱,H-2和H-7菌显著降低蛋白质含量,表明两者抑菌物质粗提物可影响病原菌菌体的代谢合成,从而使得菌体生长受到影响。
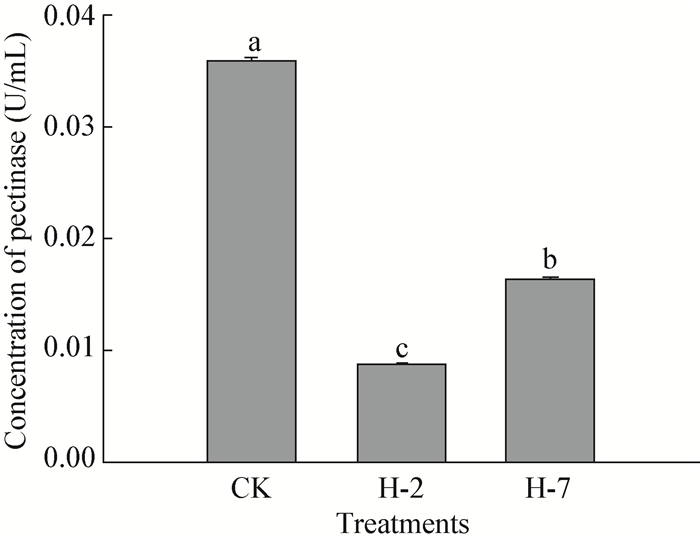
经H-2和H-7抑菌物质粗提物处理后,病原菌果胶酶活性显著下降 (P < 0.05) (),活性最低的处理为H-2处理,值为0.008 7 U/mL;其次为H-7处理,活性为0.016 U/mL,显著高于H-2处理,但最高值为对照的0.036 U/mL,显著高于H-2和H-7。有研究指出,果胶酶是病原菌的致病因子,若能抑制其活性,则可在一定程度上降低病原菌的致病力,起到抑菌作用。本研究结果显示,拮抗菌H-2和H-7能显著抑制病原菌果胶酶活性,表明两株菌可降低病原菌的致病力,可能是抑菌机理之一。
从染病蕉园的健康香蕉植株根际分离筛选到两株菌体及发酵上清液均能拮抗香蕉枯萎病病原菌的拮抗菌,编号分别为H-2和H-7;温室盆栽试验证明,两株菌均对香蕉枯萎病有一定的生防效果;经鉴定,两者分别为枯草芽孢杆菌Bacillus subtilis和解淀粉芽孢杆菌Bacillus amyloliquefaciens,均为芽孢杆菌属,有关该属的生防菌已有很多报道。戴青冬等[]筛选到两株高效生防菌枯草芽孢杆菌BLG01和BDF11,对香蕉枯萎病的防效分别达70.4%和77.2%。朱森林等[]从健康香蕉根内筛选到一株解淀粉芽孢杆菌BEB33,该菌对香蕉枯萎病有很好的生防效果。已有大量研究表明,芽孢杆菌拮抗病原菌的机理之一在于能代谢产生抑菌物质[]。卢娟等[]从海南盐碱地筛选到一株解淀粉芽孢杆菌LX1,该菌发酵上清液含有抑菌蛋白,质谱鉴定结果表明,该抑菌蛋白与B. amyloliquefaciens FZB42内切葡聚糖酶同源性最高。张龙来等[]分离到一株对香蕉枯萎病等真菌病害均有拮抗效果的解淀粉芽孢杆菌HN011,该菌能产环二肽类抑菌物质拮抗病原菌。但有关拮抗菌对病原菌的毒理效应研究较少,本研究从拮抗菌对病原菌菌丝脂质过氧化、麦角甾醇含量、蛋白质含量和果胶酶活性影响的角度探讨了两株拮抗菌的抑菌机理。
拮抗菌H-2和H-7均能显著提高菌丝丙二醛含量,降低麦角甾醇含量、蛋白含量和果胶酶活性。丙二醛含量增加和麦角甾醇含量降低,均反映了菌丝细胞膜结构受损害的程度。何璐[]和王芳[]在研究抑菌物质拮抗黄瓜枯萎病病原菌的机理时发现,随着抑菌物质浓度的提高,受试的病原菌菌丝丙二醛和麦角甾醇含量分别逐渐升高和降低,菌丝细胞膜受到的损伤程度越来越大;本研究结果与之一致,两株拮抗菌处理病原菌后,病原菌菌丝细胞膜严重受损,导致病原菌生长受到抑制,是拮抗菌H-2和H-7的抑菌机理之一。通过研究拮抗菌对病原菌菌丝蛋白质含量的影响,可在一定程度上表征对病原菌细胞内代谢物质合成的影响。本研究结果表明,拮抗菌处理后,菌丝蛋白质含量均显著降低,与对照存在显著差异,说明病原菌细胞内代谢受阻,菌体生长将受到影响,研究结果与刘先宝等[]一致。此外,果胶酶是香蕉枯萎病菌的主要致病毒力因子[],拮抗菌H-2和H-7的代谢粗提物对香蕉枯萎病菌合成的果胶酶具有显著影响,其活性显著降低,这将显著降低病原菌致病毒力,从而达到抑菌目的。王芳[]研究苦参内生真菌抑菌物质时也指出,抑菌物质可通过抑制番茄叶霉病菌胞外酶活性来降低叶霉病菌的致病性,表明胞外酶活性的抑制是降低病原菌致病力的关键机理之一。
综合本研究的结果表明,拮抗菌H-2和H-7的抑菌物质粗提物能够抑制香蕉枯萎病病原菌的菌丝果胶酶活性和蛋白质的含量,并通过破坏细胞膜结构产生抑菌作用,有关两株菌作用机理的研究可为其后续应用奠定理论基础,在实践上具有重要的应用价值,可进一步开发利用。
参考文献
Xiao AP, You CP, Liang GP, et al.
Selection of the antagonistic bacteria against Fusarium oxysporum f. sp. cubense and their action mechanisms[J].
Plant Protection, 2006, 32(4) : 53–56.
(in Chinese)
肖爱萍, 游春平, 梁关平, 等. 香蕉枯萎病拮抗菌的筛选及其作用机制研究[J].
植物保护, 2006, 32(4) : 53–56.
Lin D, Po SL, Chang CR, et al.
Effects of N, K ratios and fertilizing at different stages on off-season banana[J].
Chinese Journal of Tropical Crops, 2002, 23(2) : 36–40.
(in Chinese)
林电, 颇速亮, 常春荣, 等. 反季节组培香蕉氮钾肥料配比、施肥时期及其效应研究[J].
热带作物学报, 2002, 23(2) : 36–40.
Lin LW, Xi WP, Huang SH.
Selection of fungicides for controlling banana blight resulted from Fusarium oxysporum f. sp. cubense[J].
Ecology and Environment, 2003, 12(2) : 182–183.
(in Chinese)
林兰稳, 奚伟鹏, 黄赛花. 香蕉镰刀菌枯萎病防治药剂的筛选[J].
生态环境, 2003, 12(2) : 182–183.
Pietro AD, Huertas-González MD, Gutierrez-Corona JF, et al.
Molecular characterization of a subtilase from the vascular wilt fungus Fusarium oxysporum[J].
Molecular Plant-Microbe Interactions, 2001, 14(5) : 653–662.
DOI:10.1094/MPMI.2001.14.5.653
Waweru B, Turoop L, Kahangi E, et al.
Non-pathogenic Fusarium oxysporum endophytes provide field control of nematodes, improving yield of banana (Musa sp.[J].
Biological Control, 2014, 74 : 82–88.
DOI:10.1016/j.biocontrol.2014.04.002
Ting ASY, Mah SW, Tee CS.
Evaluating the feasibility of induced host resistance by endophytic isolate Penicillium citrinum BTF08 as a control mechanism for Fusarium wilt in banana plantlets[J].
Biological Control, 2012, 61(2) : 155–159.
DOI:10.1016/j.biocontrol.2012.01.010
Zhu SL, Liu XB, Cai JM, et al.
Isolation of endophytic bacterial BEB33 and its bio-control evaluation against banana Fusarium wilt[J].
Chinese Journal of Tropical Crops, 2014, 35(6) : 1177–1182.
(in Chinese)
朱森林, 刘先宝, 蔡吉苗, 等. 内生细菌BEB33的分离、鉴定及对香蕉枯萎病的生防作用评价[J].
热带作物学报, 2014, 35(6) : 1177–1182.
Cao ZC, Wang J, Wang GF, et al.
Optimization of liquid fermentation medium of an antagonistic Bacillus sp. against banana Fusarium wilt[J].
Molecular Plant Breeding, 2016, 14(4) : 1003–1008.
(in Chinese)
曹智淳, 汪军, 王国芬, 等. 一株拮抗香蕉枯萎病芽胞杆菌的液体发酵培养基优化[J].
分子植物育种, 2016, 14(4) : 1003–1008.
Lu CY, Ma Y, Wang Q, et al.
Effects of Trichoderma viride TV41 on spatial distribution of Fusarium oxysporum FW0 around watermelon plant and fusarium wilt control[J].
Microbiology China, 2015, 42(11) : 2159–2167.
(in Chinese)
陆楚月, 马艳, 王巧, 等. 绿色木霉TV41对尖孢镰刀菌FW0在西瓜植株空间分布和枯萎病防控效果的影响[J].
微生物学通报, 2015, 42(11) : 2159–2167.
Zhu TH, Yang ZZ.
A study on strain degeneration and its control of Bacillus subtilis[J].
Journal of Southwest Forestry College, 2000, 20(1) : 31–35.
(in Chinese)
朱天辉, 杨佐忠. 枯草芽孢杆菌菌种退化及其控制[J].
西南林学院学报, 2000, 20(1) : 31–35.
Yuan J, Li B, Zhang N, et al.
Production of bacillomycin-and macrolactin-type antibiotics by Bacillus amyloliquefaciens NJN-6 for suppressing soilborne plant pathogens[J].
Journal of Agricultural and Food Chemistry, 2012, 60(12) : 2976–2981.
DOI:10.1021/jf204868z
Sun JB, Wang YG, Li W, et al.
Screening and identification of chitinase-producing bacterium and its antagonistic activity against Fusarium oxysporum f. sp. cubense[J].
Journal of Fruit Science, 2010, 27(3) : 427–430.
(in Chinese)
孙建波, 王宇光, 李伟, 等. 产几丁质酶香蕉枯萎病拮抗菌的筛选、鉴定及抑菌作用[J].
果树学报, 2010, 27(3) : 427–430.
Raza W, Yuan J, Ling N, et al.
Production of volatile organic compounds by an antagonistic strain Paenibacillus polymyxa WR-2 in the presence of root exudates and organic fertilizer and their antifungal activity against Fusarium oxysporum f. sp. niveum[J].
Biological Control, 2015, 80 : 89–95.
DOI:10.1016/j.biocontrol.2014.09.004
Yu J, Zhang RY, Tan ZQ, et al.
Studies on antifungal activity and purification of antifungal substance from Bacillus subtilis B25 strain[J].
Genomics and Applied Biology, 2016, 35(3) : 629–634.
(in Chinese)
于杰, 张荣意, 谭志琼, 等. 枯草芽孢杆菌B25抗真菌作用及抗菌蛋白的分离纯化[J].
基因组学与应用生物学, 2016, 35(3) : 629–634.
Wang F. Screening of endophytic bacteria from Sophora flavescens and identification of its antagonistic substances[D]. Shenyang: Doctoral Dissertation of Shenyang Agricultural University, 2011 (in Chinese)
王芳. 苦参内生拮抗细菌筛选及其抗菌物质纯化鉴定[D]. 沈阳: 沈阳农业大学博士学位论文, 2011
Liu XB, Cai JM, Chen YP, et al.
Antimicrobial mechanism of endophytic bacteria isolated from banana[J].
Chinese Journal of Tropical Agriculture, 2016, 36(1) : 47–50.
(in Chinese)
刘先宝, 蔡吉苗, 陈奕鹏, 等. 一株拮抗香蕉枯萎病菌内生细菌的抑菌机制研究[J].
热带农业科学, 2016, 36(1) : 47–50.
Fang ZD.
Plant Diseases Research Methods[M].
Beijing:
China Agriculture Press, 1998: 1
-344.
(in Chinese)
方中达.
植病研究方法[M].
北京:
中国农业出版社, 1998: 1
-344.
Jourdan E, Henry G, Duby F, et al.
Insights into the defense-related events occurring in plant cells following perception of surfactin-type lipopeptide from Bacillus subtilis[J].
Molecular Plant-microbe Interactions, 2009, 22(4) : 456–468.
DOI:10.1094/MPMI-22-4-0456
Cao FM, Shen DL, Li J, et al.
Multiplex-PCR approach to identify Bacillus species applied in microbial fertilizers[J].
Acta Microbiologica Sinica, 2008, 48(5) : 651–656.
(in Chinese)
曹凤明, 沈德龙, 李俊, 等. 应用多重PCR鉴定微生物肥料常用芽孢杆菌[J].
微生物学报, 2008, 48(5) : 651–656.
Zhao SJ, Xu ZC, Zou Q, et al.
Improvements of method for measurement of malondialdehvde in plant tissues[J].
Plant Physiology Communications, 1991, 30(3) : 207–210.
(in Chinese)
赵世杰, 许长成, 邹琦, 等. 植物组织中丙二醛测定方法的改进[J].
植物生理学通讯, 1991, 30(3) : 207–210.
He L. Isolation and identification of the antagonistic substances of the endophytic fungi from Sophora flavescens and its function mechanism[D]. Shenyang: Doctoral Dissertation of Shenyang Agricultural University, 2011 (in Chinese)
何璐. 苦参内生真菌抑菌物质纯化鉴定及作用机制研究[D]. 沈阳: 沈阳农业大学博士学位论文, 2011
Han P, Liu XL, Liu PF, et al.
Effect of novel fungicide 5-(4-Chloro phenyl)-2, 3-dimethyl-3-(pyrid ine-3)-oxazoline on ergosterol biosynthesis in Botrytis Cinerea by high performance liquid chromatography[J].
Chinese Journal of Analytical Chemistry, 2006, 34(10) : 1467–1470.
(in Chinese)
韩平, 刘西莉, 刘鹏飞, 等. 高效液相色谱法研究啶菌噁唑对番茄灰霉病菌麦角甾醇生物合成的影响[J].
分析化学, 2006, 34(10) : 1467–1470.
DOI:10.3321/j.issn:0253-3820.2006.10.026
Dai QD, Wang J, Xing YF, et al.
Screening and biological control effect of two antagonistic bacteria against banana fusarium wilt[J].
Guangdong Agricultural Sciences, 2014, 41(11) : 73–77.
(in Chinese)
戴青冬, 汪军, 邢益范, 等. 两株抗香蕉枯萎病生防菌的筛选与生防效应研究[J].
广东农业科学, 2014, 41(11) : 73–77.
DOI:10.3969/j.issn.1004-874X.2014.11.017
Lu J, Xia QY, Gu WL, et al.
Isolation, identification of Bacillus amyloliquefaciens LX1 strain againsts Fusarium oxysporum f. sp. cubense and cloning of its antifungal protein gene[J].
Chinese Journal of Tropical Crops, 2013, 34(1) : 117–124.
(in Chinese)
卢娟, 夏启玉, 顾文亮, 等. 拮抗香蕉枯萎病菌的解淀粉芽孢杆菌LX1菌株的鉴定及其抗菌蛋白基因的克隆[J].
热带作物学报, 2013, 34(1) : 117–124.
Zhang LL, Kang XH, Wei XY, et al.
Research on secondary metabolites from Bacillus amyloliquefaciens strain HN011[J].
Journal of South China Agricultural University, 2016, 37(1) : 63–69.
(in Chinese)
张龙来, 康向辉, 魏孝义, 等. 1株解淀粉芽孢杆菌HN011抑菌次级代谢产物的分析[J].
华南农业大学学报, 2016, 37(1) : 63–69.
DOI:10.7671/j.issn.1001-411X.2016.01.011
Dong ZY, Wang Q, Qin SW, et al.
Comparison of cell wall degrading enzymes produced by Fusarium oxysporum f. sp. cubense race 1 and race 4[J].
Acta Phytopathologica Sinica, 2010, 40(5) : 463–468.
(in Chinese)
董章勇, 王琪, 秦世雯, 等. 香蕉枯萎病菌1号和4号生理小种细胞壁降解酶的比较[J].
植物病理学报, 2010, 40(5) : 463–468.