一种生物防治菌bacillus siamensis ht1及其在制备生防菌剂中的应用
技术领域
1.本发明属于农业微生物学技术领域,照顾小孩13825404095具体涉及一种生物防治菌bacillus siamensis ht1及其在制备生防菌剂中的应用。
背景技术:2.大豆根腐病主要由镰孢菌(fusarium spp.)、大豆疫霉(phytophthora sojae)、腐霉菌(pythium spp.)和立枯丝核菌(rhizoctonia solani)引起。其中尖孢镰刀菌(fusarium oxysporum)和大豆疫霉(phytophthora sojae)是主要的大豆根腐病病原菌。该病害在整个大豆生长期均可发生,发病严重时可直接导致整个植株死亡,从而造成巨大的经济损失。
3.长期以来,防治大豆根腐病的方法主要是大量施用化学农药和选育抗病品种,但是根腐病菌繁殖快、变异度大等特点使得化学药剂极易产生抗药性,加之品种的抗病程度不高、人们对抗药性及食品安全问题的认识提高等,使得利用生物防治大豆根腐病的方法越来越受到关注。微生物农药与化学农药相比,具有选择性强、无污染、不易产生抗药性、不破坏生态环境等特点,现已成为研究热点。
4.在诸多生防细菌中,迄今为止研究较多的一类仍然是芽孢杆菌(bacillus spp.),因其具有极强的抗逆能力和抗菌活性,是根际细菌(pgpr)的重要成员,对促进植物生长和抑制植物病害发挥重要作用。而且芽孢杆菌繁殖速度快,人工培养容易,已经作为生防菌剂广泛应用于生产实践。
5.目前,用于防治大豆根腐病的暹罗芽孢杆菌鲜有报道。因此,本发明为寻找新的菌株用于大豆根腐病的防治提供了较大的理论基础。
技术实现要素:6.本发明的目的在于提供了一株生物防治菌bacillus siamensis ht1,其保藏编号为cctcc no:m 20211539,分类命名为bacillus siamensis ht1。
7.本发明的另一个目的在于提供了上述生物防治菌bacillus siamensis ht1在制备生防菌剂中的应用,特别是在制备大豆根腐病(soybean root rot)防治剂方面的应用。
8.本发明的bacillus siamensis ht1分离自吉林省长春市吉林农业大学教学科研基地大豆田大豆根际土壤,该菌株已送至中国典型培养物保藏中心(cctcc)保藏,保藏日期为2021年12月3日,保藏编号为cctcc no:m 20211539,分类命名为bacillus siamensis ht1,地址:中国湖北省武汉市武汉大学(430072)。菌落特性:菌落呈白色、圆形、表面褶皱、湿润、凸起、不透明(图1)。
9.bacillus siamensis ht1的应用,包括利用该菌株制备用于防治植物病原菌的生防菌剂,所述的植物病原菌包括但不限于:大豆根腐病菌(fusarium oxysporum)、大豆疫霉菌(phytophthora sojae)、大豆拟茎点种腐病菌(phomopsis longicolla hobbs)大豆核盘
菌(sclerotinia sclerotiorum)玉米小斑病菌(bipolaris maydis)、玉米茎腐病菌(fusarium graminearum)、人参根腐病菌(fusarium solani)、番茄灰霉病菌(botrytis cinerea)。
10.与现有技术相比,本发明具有以下优点:利用本发明提供的bacillus siamensis ht1可有效抑制大豆上重要病原菌生长,且抑制效果较好。避免化学防治对环境和作物安全的潜在不良影响。
附图说明
11.图1为ht1菌株菌落特点示意图(lb固体,30℃,18h);
12.图2为ht1菌株扫描电镜图(lb固体,30℃,18h);
13.图3为ht1菌株系统发育树(基于16s rdna序列);
14.图4为ht1菌株的生长曲线(lb液体,30℃,48h);
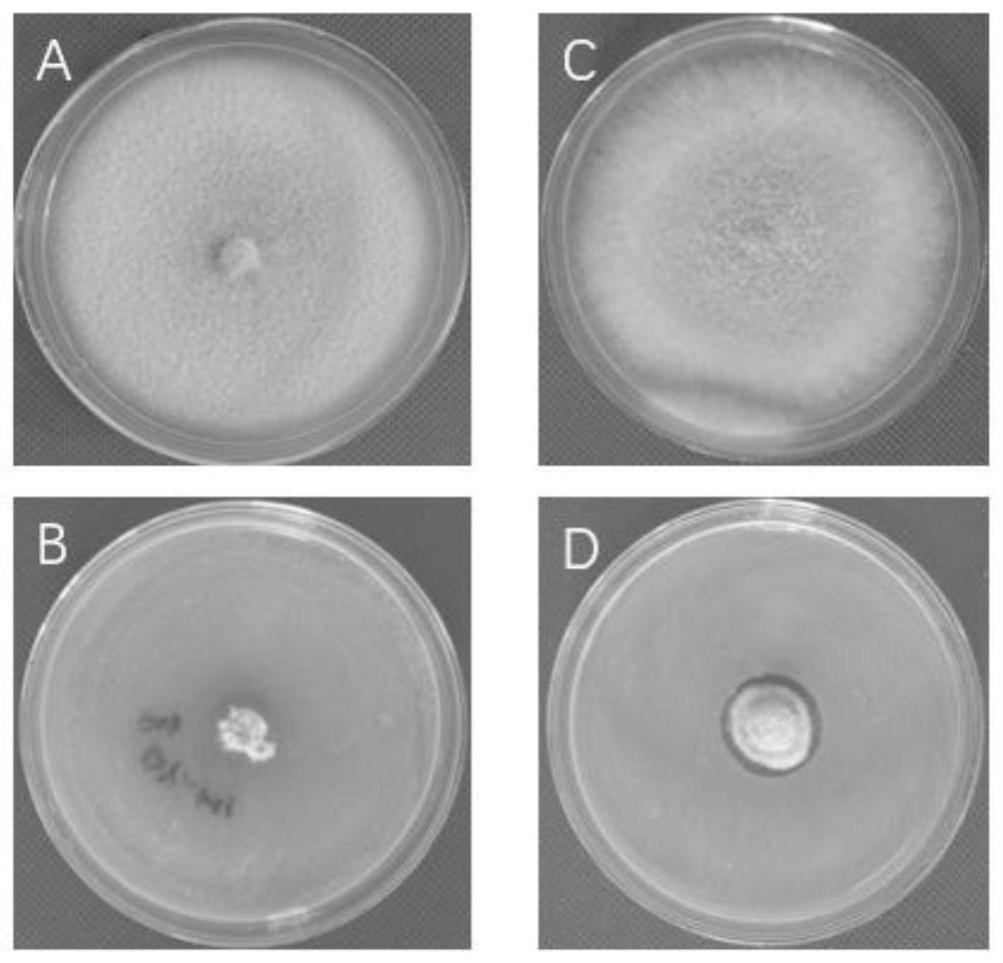
15.图5为ht1菌株与大豆根腐病的对峙培养示意图(pda,25℃,7d);
16.图6为ht1菌株与多种病原菌的对峙培养示意图(pda,25℃,7d);
17.图7为不同浓度ht1菌株对大豆根腐病的抑制作用曲线(pda,25℃,7d);
18.图8为不同浓度ht1菌株对大豆根腐病菌丝生长量的抑制作用曲线(pda,25℃,7d);
19.图9为ht1菌株对大豆根腐病菌丝形态的影响结果照片(pda,25℃,2d);
20.图10为ht1菌株在不同温度下对大豆根腐病的抑制作用曲线(pda,25℃,7d);
21.图11为ht1菌株在不同ph下对大豆根腐病的抑制作用曲线(pda,25℃,7d);
具体实施方式
22.为了更好地解释本发明,以下结合具体实施例进一步阐明本发明的主要内容,但本发明的内容不仅仅局限于以下实施例。本发明实施例所涉及的技术方案,如未特别说明,均为本领域常规方案;所述试剂或材料,如未特别说明,均来源于商业渠道。
23.实施例1:bacillus siamensis ht1(ht1菌株)的分离鉴定及生物学特性分析
24.一、菌株的分离及其生物学特性分析
25.从吉林农业大学教学科研基地(吉林省长春市新城大街2888号)采集大豆根际土壤样品。将10g该土壤样品,放入盛有90ml无菌水的三角瓶中置于30℃、150r
·
min-1
摇床上震荡30min,使之充分混匀。将样品静置10min后,吸取1ml上清液,用无菌水将其逐级稀释为10-1
、10-2
、10-3
、10-4
、10-5
、10-6
、10-7
梯度浓度的悬浮液,每个梯度取0.2ml悬浮液涂布于na固体培养基平板上,每个浓度各三个重复,置于28℃恒温箱中倒置培养24h。挑取形态不同的细菌菌落在lb固体培养基上经平板划线法纯化、纯化后编号保存。
26.pda固体培养基中央位置分别接种直径为5mm大豆根腐病菌菌饼(尖孢镰刀菌和大豆疫霉菌),再于pda固体培养基上距离菌饼上下左右各约20mm的四个位置接种纯化后的细菌菌株作为实验组;以只接种大豆根腐病菌菌饼的pda固体培养基为对照。每个处理重复3次,实验重复两次,于28℃恒温箱倒置培养,待对照组的平板长满时,观察实验组的平板中是否有抑菌带。选择抑菌带明显的菌株作为大豆根腐病生物防治菌,将其命名为ht1菌株,即bacillus siamensis ht1。
27.所述na固体培养基为:牛肉膏30.0g、蛋白胨50.0g、氯化钠30.0g、琼脂20.0g、蒸馏水1000.0ml。
28.所述的lb固体培养基为:胰蛋白胨10.0g、酵母浸粉5.0g、氯化钠10.0g、琼脂粉20.0g、蒸馏水1000.0ml。
29.所述pda固体培养基为:马铃薯200.0g、葡萄糖20.0g、琼脂粉20.0g、蒸馏水1000.0ml。
30.二、菌株的形态学特征
31.ht1菌株培养(lb固体培养基,30℃)18h,菌落呈白色、圆形、表面褶皱、湿润、凸起、不透明。(图1)
32.三、扫描电镜观察结果
33.该ht1菌株电镜观察为表面不光滑,杆状细菌。(图2)
34.四、生理生化特征分析
35.参考《微生物学实验》(沈萍,范秀容,李广武.微生物学实验(第三版).北京:高等教育出版社,1999.)和《常见细菌系统鉴定手册》(东秀珠,蔡妙英.常见细菌系统鉴定手册.北京:科学出版社,2011.)测定ht1菌株的生理生化特征。
36.测定结果显示,该菌株甲基红反应、精氨酸双水解反应、淀粉水解反应、尿酶反、v-p反应呈阴性;革兰氏、酪蛋白水解反应、甲硫氨酸水解反应、麦芽糖利用、蔗糖利用、明胶液化均呈阳性;不能利用柠檬酸盐、可利用硝酸盐;可产生吲哚。
37.四、ht1菌株的分类属性鉴定
38.通过细菌基因组dna提取试剂盒(天根生化科技(北京)有限公司,北京,中国)提取ht1菌株dna。
39.采用通用引物聚合酶链反应(pcr)扩增16s rdna基因,引物为27f(5
‘‑
agagttgatcctgctcag-3’),1492r(5
‘‑
gttacctttacgactt-3’)。50μl扩增体系:premix taq 25μl,模版(ht1菌株dna)5μl,引物各2.5μl,用ddh2o补足50μl。pcr循环参数为:95℃预加热5min,95℃变性30s,56℃退火30s,72℃延伸1.5min,72℃下延伸10min,用1%琼脂糖凝胶电泳和胶回收进行纯化。通过试剂盒(天根生化科技(北京)有限公司,北京,中国)提取,然后由生工生物技术有限公司进行测序(中国上海)。测序结果用blast软件genbank中的16srdna序列进行同源性比较,获得ht1菌株的16s rdna的核苷酸序列如seq id no.1所示。构建生物防治菌的系统发育树,确定ht1为暹罗芽孢杆菌,并命名为bacillus siamensis ht1(图3),-80℃冰箱保存。
40.该菌株已送至中国典型培养物保藏中心保藏,保藏编号为cctcc no:m20211539,分类命名为bacillus siamensis ht1,地址:中国湖北省武汉市武昌区八一路299号,武汉大学。
41.实施例2:ht1菌株纯化、发酵培养以及生长曲线的绘制
42.(1)菌株活化:将-80℃保存的ht1菌株取出,在冰上融化后,将其接入lb液体培养基中,28℃、150r
·
min-1
过夜培养12h。
43.(2)菌株培养:将步骤(1)中培养12h的ht1菌株转接至新鲜的lb固体培养基上,28℃恒温箱中培养18h,然后于4℃保存。
44.(3)菌株发酵:用接种环将步骤(2)中的ht1菌株接种于lb液体培养基中,150r
·
min-1
、28℃振荡培养至对数期(od
600
=0.5),获得种子液。吸取0.5ml该种子液转入含有100ml lb液体培养基的250ml三角瓶中,150r
·
min-1
、28℃振荡培养3天,8000rpm离心5min,将离心得到的菌体用无菌水调至浓度为1
×
108cfu/ml,制得发酵液。用于以下实施例。
45.所述的lb液体培养基为:胰蛋白胨10.0g、酵母浸粉5.0g、氯化钠10.0g、蒸馏水1000.0ml。
46.所述的lb固体培养基为:胰蛋白胨10.0g、酵母浸粉5.0g、氯化钠10.0g、琼脂粉20.0g、蒸馏水1000.0ml。
47.(4)生长曲线的绘制
48.将步骤(2)于4℃保存的ht1菌株用接种环挑取接种于含有100ml lb液体培养基的250ml三角瓶中,28℃、150r
·
min-1
下培养至对数期(od
600
=0.5),制备种子液。吸取0.5ml该种子液转接于100ml的lb液体培养基中,每隔两小时测定菌液的od
600
值,连续测定48h,绘制生长曲线(图4)。
49.实施例3:ht1菌株抑菌谱的测定
50.利用实施例2步骤(3)制备的浓度为1
×
108cfu/ml的发酵液,按照100ml pda固体培养基中加入0.5ml发酵液的比例制备含ht1菌液的pda固体培养基,待pda固体培养基凝固后,在培养基的中央位置分别接种直径为5mm的尖孢镰刀菌(fusarium oxysporum)、大豆疫霉病菌(phytophthora sojae)、大豆拟茎点种腐病菌(phomopsis longicolla hobbs)、大豆核盘菌(sclerotinia sclerotiorum)玉米小斑病菌(bipolaris maydis)、玉米茎腐病菌(fusarium graminearum)、人参根腐病菌(fusarium solani)、番茄灰霉病菌(botrytis cinerea)的病原菌块,作为处理组。以在不含ht1菌液的pda固体培养基的中央位置接种直径为5mm的上述病原菌块为对照组。在28℃培养7天,观察抑菌情况,计算抑制率。每个处理重复3次,实验重复两次。
51.所述的pda固体培养基为:葡萄糖20.0g、琼脂粉20.0g、马铃薯200.0g、蒸馏水1000.0ml。
52.抑制率(%)=(对照组的菌落直径-处理组的菌落直径)/对照组的菌落直径
×
100%。
53.7天后,测定对照组与处理组的菌落直径。可以得出,ht1菌株对多种病原菌均有明显的抑制作用。图5为ht1菌株对大豆根腐病两种病原菌的抑制作用,表1为ht1菌株对多种病原菌抑制率数据。其中,a与b为大豆疫霉菌(phytophthora sojae),ht1菌株对其抑制率为82.44%;c与d为尖孢镰刀菌(fusarium oxysporum),ht1菌株对其抑制率为80.91%;(其中a、c为对照组,b、d为处理组)。图6为ht1菌株对多种病原菌的抑制作用,a与b为大豆拟茎点种腐病菌(phomopsis longicolla hobbs),ht1菌株对其抑制率为57.89%;c与d为大豆核盘菌(sclerotinia sclerotiorum),ht1菌株对其抑制率为82.22%;e与f为玉米小斑病(bipolaris maydis),ht1菌株对其抑制率为76.67%;g与h为玉米茎腐病菌(fusarium graminearum),ht1菌株对其抑制率为72.22%;i与j为人参根腐病菌(fusarium solani),ht1菌株对其抑制率为74.44%。k与l为番茄灰霉病菌(botrytis cinerea),ht1菌株对其抑制率为80.1%(其中a、c、e、g、i、k为对照组,b、d、f、h、j、l为处理组)。
54.表1ht1菌株对多种病原菌抑制率
55.序号病原菌抑制率(%)
1大豆疫霉菌82.442尖孢镰刀菌80.913大豆拟茎点种腐病菌57.894大豆核盘菌82.225玉米小斑病76.676玉米茎腐病菌72.227人参根腐病菌74.448番茄灰霉病菌80.1
56.实施例4:ht1菌株对大豆根腐病的抑制作用
57.利用实施例2步骤(3)制备的浓度为1
×
108cfu/ml的发酵液,用无菌水将发酵液浓度调为1
×
104cfu/ml、1
×
105cfu/ml、1
×
106cfu/ml、1
×
107cfu/ml、1
×
108cfu/ml。按照100ml pda固体培养基中添加0.5ml生物防治菌发酵液的比例,制备含有生物防治菌发酵液的pda固体培养基,将生长良好的尖孢镰刀菌和大豆疫霉菌菌饼接取5mm接种于pda固体培养基的中央位置作为处理组,同时在不添加生物防治菌发酵液的pda固体培养基上接种生长良好的尖孢镰刀菌和大豆疫霉菌作为空白对照组(control),于28℃下培养7天,观察抑菌情况,计算抑制率。处理重复3次,实验进行两次。
58.抑制率(%)=(对照组菌落直径-处理组菌落直径)/对照组菌落直径
×
100%
59.7天后,测定对照组与处理组的菌落直径。如图7和表2所示,随着菌液浓度的升高,尖孢镰刀菌和大豆疫霉菌的菌落直径不断下降。当菌液浓度为1
×
104cfu/ml时,抑制率分别为46.67%和40.82%;当菌液浓度为1
×
105cfu/ml时,抑制率分别为57.41%和57.15%;当菌液浓度为1
×
106cfu/ml时,抑制率分别为69.26%和67.90%;当菌液浓度为1
×
107cfu/ml时,抑制率分别为75.19%和75.38%;在菌液浓度为1
×
108cfu/ml时,抑制率分别为80.91%和82.44%。
60.表2不同浓度ht1菌株对大豆根腐病抑制率
[0061][0062][0063]
实施例5:ht1菌株对大豆根腐病菌丝生长量的抑制作用
[0064]
利用实施例2步骤(3)制备的浓度为1
×
108cfu/ml的发酵液,用无菌水将发酵液浓度调为1
×
104cfu/ml、1
×
105cfu/ml、1
×
106cfu/ml、1
×
107cfu/ml、1
×
108cfu/ml。按照100ml pda固体培养基中添加0.5ml生物防治菌发酵液的比例,制备含有生物防治菌发酵液的pda固体培养基,将生长良好的尖孢镰刀菌和大豆疫霉菌菌饼接取5mm接种于pda固体培
养基的中央位置作为处理组,同时在不添加生物防治菌发酵液的pda固体培养基上接种生长良好的尖孢镰刀菌和大豆疫霉菌作为空白对照组(control),于28℃下培养7天,将菌丝用无菌的刀片刮下,称重,计算抑制率。处理重复3次,实验进行两次。
[0065]
抑制率(%)=(对照组菌丝的重量-处理组菌丝的重量)/对照组菌丝的重量
×
100%
[0066]
7天后,测定对照组与处理组的菌丝重量。如图8和表3所示,随着菌液浓度的升高,尖孢镰刀菌和大豆疫霉菌菌丝重量均不断下降(control)。当菌液浓度为1
×
104cfu/ml时,抑制率分别为40.75%和34.75%;当菌液浓度为1
×
105cfu/ml时,抑制率分别为57.08%和47.87%;当菌液浓度为1
×
106cfu/ml时,抑制率分别为68.42%和59.75%;当菌液浓度为1
×
107cfu/ml时,抑制率分别为79.68%和77.66%;在菌液浓度为1
×
108cfu/ml时,抑制率分别为84.77%和86.70%。
[0067]
表3不同浓度ht1菌株对大豆根腐病菌丝生长量抑制率
[0068][0069]
实施例6:ht1菌株对大豆根腐病菌丝形态的影响
[0070]
利用实施例2步骤(3)制备的浓度为1
×
108cfu/ml的发酵液。按照100ml pda固体培养基中添加0.5ml生物防治菌发酵液的比例,制备含有生物防治菌发酵液的pda固体培养基,将生长良好的尖孢镰刀菌(图9a、c)和大豆疫霉菌(图9b、d)菌饼接种于pda固体培养基的中央作为处理组,同时在不添加生物防治菌发酵液的pda固体培养基上接种生长良好的尖孢镰刀菌和大豆疫霉菌作为空白对照,28℃培养2天,将菌饼取下,放置于光学显微镜下进行观察,观察菌丝形态上的变化。处理重复三次,实验进行两次。
[0071]
在低倍镜下,就可以观察到处理组和对照组的菌丝有明显的差异。处理组的菌丝有向上生长的趋势,向四周生长的趋势较小,菌丝较短,且密集(图9a、c)。而对照组的菌丝,向四周生长的趋势较为明显,菌丝较长,菌丝分布的较稀疏(图9b、d)。
[0072]
实施例7:ht1菌株在不同温度下对大豆根腐病的抑制作用
[0073]
利用实施例2步骤(3)制备的浓度为1
×
108cfu/ml的发酵液,按照100ml pda固体培养基中添加0.5ml生物防治菌发酵液的比例,制备含有生物防治菌发酵液的pda固体培养基,将生长良好的尖孢镰刀菌和大豆疫霉菌菌饼接种于pda固体培养基的中央作为处理组,同时在不添加生物防治菌发酵液的pda固体培养基上接种生长良好的尖孢镰刀菌和大豆疫霉菌作为空白对照,将其分别在20℃、25℃、30℃、35℃、40℃下培养7天,观察抑菌情况,计算ht1菌株对大豆根腐病的抑制率。每个处理重复三次。
[0074]
抑制率(%)=(对照组菌落直径-处理组菌落直径)/对照组菌落直径
×
100%
[0075]
7天后,测定对照组与处理组的菌落直径。如图10和表4所示,随着温度的升高,ht1菌株对大豆根腐病的抑制作用呈现先上升后下降的趋势,当温度为25℃时,ht1菌株对尖孢镰刀菌和大豆疫霉菌的抑制作用达到最大,抑制率分别为81.35%和82.90%。
[0076]
表4不同温度下ht1菌株对大豆根腐病菌抑制率
[0077][0078][0079]
实施例8:ht1菌株在不同ph下对大豆根腐病的抑制作用
[0080]
利用实施例2步骤(3)制备的浓度为1
×
108cfu/ml的发酵液,按照100ml pda固体培养基中添加0.5ml生物防治菌发酵液的比例,制备ph分别为2、3、4、5、6、7、8、9、10含有生物防治菌发酵液的pda固体培养基,将生长良好的尖孢镰刀菌和大豆疫霉菌菌饼接种于pda固体培养基的中央作为处理组,同时在不添加生物防治菌发酵液的pda固体培养基上接种生长良好的尖孢镰刀菌和大豆疫霉菌作为空白对照,将其在28℃培养7天,观察抑菌情况,计算ht1菌株对大豆根腐病的抑制率。每个处理重复三次。
[0081]
抑制率(%)=(对照组菌落直径-处理组菌落直径)/对照组菌落直径
×
100%
[0082]
7天后,测定对照组与处理组的菌落直径。由图11和表5所示,随着ph的升高,ht1菌株对大豆根腐病的抑制作用呈现先上升后下降的趋势,当ph为7时,ht1菌株对尖孢镰刀菌和大豆疫霉菌的抑制作用达到最大,抑制率分别为81.04%和82.83%。
[0083]
表5不同ph下ht1菌株对大豆根腐病菌抑制率
[0084]
[0085]
实施例10:ht1菌株发酵液对大豆根腐病的盆栽预防效果
[0086]
采用高粱粒接种法,以尖孢镰刀菌(fusarium oxysporum)和大豆疫霉菌(phytophthora sojae)为供试病原菌,测定生防ht1菌株对大豆根腐病的预防效果和治疗效果。每处理25株,重复三次。
[0087]
病原菌接种体按盆栽土壤重量(3kg)的4%与无菌土壤混匀装盆,加水保持含水量40%~60%,温度25
±
2℃。大豆种子(吉大豆1号)经表面消毒后播种,每盆播9粒,出苗后,间苗保留每盆5株。
[0088]
ht1菌株发酵液的制备:将-80℃冰箱中保存的ht1菌株,在冰上融化后,将其接入lb液体培养基上中,过夜培养12h后接种在lb固体培养基上,30℃活化培养24h。用接种环挑取菌株菌落,接入100ml(250ml三角瓶)的lb培养液中,30℃,150r
·
min-1
振荡培养18h,制备ht1菌株发酵液,用无菌水调整ht1菌株发酵液的最终浓度为1
×
108cfu/ml。
[0089]
病原菌接种体的制备:将高粱粒煮熟后装入250ml锥形瓶内,121℃,灭菌30min,重复1次,待其冷却后,分别接入10个pda培养7天的两种病原菌饼,25℃黑暗条件下培养20天,待高粱粒表面长满菌丝的病原菌接种体用于接种。
[0090]
预防效果的测定方法:将ht1菌株发酵液以每盆30ml的施用量浇灌于处理后的土壤中。于25℃下保湿24h后,将大豆种子播种于处理后的土壤中,每个处理重复三次。同时设置对照(ck)试验,处理后第28天调查发病情况,根据大豆根腐病分级标准调查根、茎部发病情况,记录总株数、病株数,并计算病情指数和防治效果。
[0091]
表6大豆根腐病分级标准
[0092]
分级分级标准0幼苗茎基部和主根上均无病斑1茎基部和主根上有少量病斑,病斑面积在1/4以下2茎基部和主根上病斑面积占茎基部和主根总面积的1/4~1/23茎基部和主根上病斑面积占茎基部和主根总面积的1/2~3/44茎基和主根上病斑连片,形成绕茎现象,但根系并未坏死5根系坏死,地上部萎蔫或死亡
[0093][0094][0095]
治疗效果的测定:先将大豆种子播种于处理后的土壤中,于25℃下保湿24h后,将ht1菌株发酵液以每盆30ml的施用量浇灌于处理后的土壤中,每个处理重复三次作为处理组。同时设置对照组(ck)试验,处理后第28天调查发病情况并计算病情指数和防治效果。
[0096]
28天后调查发病情况,由表7可得,ht1菌株对尖孢镰刀菌的预防和治疗效果分别为79.31%和62.63%。由表8可得,ht1菌株对大豆疫霉菌的预防和治疗效果分别为79.17%和62.21%。表明ht1菌株可有效防治由两种病原菌所引起的大豆根腐病。
[0097]
表7:ht1菌株对尖孢镰刀菌的预防和治疗效果试验数据
[0098][0099]
注:表中数据为平均数
±
标准差;小写字母a、b表示p《0.05水平下的差异显著性。
[0100]
表8:ht1菌株对大豆疫霉菌的预防和治疗效果试验数据
[0101][0102]
注:表中数据为平均数
±
标准差;小写字母a、b表示p《0.05水平下的差异显著性。

